实验室用固态不纯氯化钠(含少量NH4HCO3和Na2SO4杂质)配制氯化钠溶液。下列操作可供选用:①逐滴加入稀盐酸,调节pH值为5;②煮沸;③加蒸馏水溶解;④加热至不再产生气体为止;⑤加入稍过量的Na2CO3溶液;⑥加入稍过量的BaCl2溶液;⑦过滤。上述实验操作的正确顺序应是( )
| A.①②⑤⑥⑦③④ | B.③④⑥⑤⑦①② |
| C.④③⑥⑤⑦①② | D.④③⑤⑥⑦②① |
下列离子方程式与所述事实相符且正确的是( )
| A.漂白粉溶液在空气中失效: ClO-+CO2+H2O=HClO+HCO3- |
B.用浓盐酸与MnO2反应制取少量氯气: MnO2+2H++2Cl- Mn2++Cl2↑+2H2O Mn2++Cl2↑+2H2O |
| C.向NaAlO2溶液中通入过量CO2制Al(OH)3: AlO2-+CO2+2H2O=Al(OH)3↓+HCO |
| D.在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4: |
3ClO-+2Fe(OH)3===2FeO42-+3Cl-+H2O+4H+
NA代表阿伏加德罗常数的数值,下列说法正确的是( )
| A.标准状况下,11.2 L氯仿中含有C—Cl键的数目为1.5 NA |
| B.常温下,42 g丁烯和环丙烷的混合气体中含有的碳碳单键数目为3NA |
| C.常温下,1 mol SiC中含有Si—C键的数目为4NA |
| D.常温常压下,17 g甲基(—14CH3)所含的中子数为9 NA |
下列各组中的反应,属于同一反应类型的是()
| A.苯的硝化反应;乙烯使溴水褪色 |
| B.葡萄糖与新制氢氧化铜共热;无水乙醇和浓硫酸共热制乙烯 |
| C.乙醇和乙酸制乙酸乙酯;乙烷和氯气制氯乙烷 |
| D.乙醇和氧气制乙醛;苯和氢气制环己烷 |
已知硫化亚铜与一定浓度的硝酸共热,所得溶液中只有硝酸铜和硫酸铜,放出一氧化氮和二氧化氮两种气体,且两种气体的物质的量之比为3:7,则参加反应的硫化亚铜和作氧化剂的硝酸的物质的量之比为
| A.4:25 | B.2:17 | C.1:7 | D.3:8 |
在VL密闭容器中,通入0.2mol SO2和0.2mol SO3气体,在一定条件下发生反应:2SO2+O2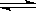 2SO3。平衡时SO3为amol;在相同温度下按下列配比在VL密闭容器中放入起始物质,平衡时有关SO3的正确叙述是
2SO3。平衡时SO3为amol;在相同温度下按下列配比在VL密闭容器中放入起始物质,平衡时有关SO3的正确叙述是
| A.放入0.2mol SO2、0.1molO2、0.1mol SO3,达到平衡时SO3必小于amol |
| B.放入0.2mol SO2、0.1molO2、0.2mol SO3,达到平衡时SO3必小于amol |
| C.放入0.4mol SO2、0.1molO2,达到平衡时SO3会等于0.4mol |
| D.放入0.2mol SO2、0.1molO2,达到平衡时SO3必小于amol |