25℃和1.01×105Pa时,反应:2N2O5(g) = 4NO2(g)+O2(g) △H= +56.76kJ/mol,自发进行的原因是
| A.是吸热反应 | B.是放热反应 |
| C.是熵减少的反应 | D.熵增大效应大于能量效应。 |
下列说法正确的是:
| A.相同温度时,1mol/L氨水与0.5mol/L氨水中,C(OH-)之比是2∶1 |
| B.1mol/L NH4Cl溶液中 C(NH4+) = C(Cl-) |
| C.0.1mol/LCH3COONa溶液中加少量CH3COOH溶液,使溶液呈中性,此时混合液中C (Na+) =" C" (CH3COO-) |
| D.硫化钠溶液中,C (Na+) =" 2" C (S2-) |
能说明醋酸是弱电解质的事实是:
①用浓硫酸和醋酸钠固体共热可以制得醋酸,②醋酸钠水溶液呈碱性,
③可以用食醋清除水壶中的水垢,④pH=2的醋酸溶液稀释1000倍后的pH<5
| A.①③④ | B.①② | C.②④ | D.② |
图中,两电极上发生的电极反应为:a极:Cu2+ + 2 e-= Cu b极:Fe - 2 e-= Fe2+
下列说法中不正确的是
| A.该装置可能是电解池 |
| B.a极上一定发生还原反应 |
| C.a、b可能是同种电极材料 |
| D.该过程中能量的转换一定是化学能转化为电能 |
下列离子方程式正确的是
A.用惰性电极电解饱和氯化钠溶液:2Cl- + 2H+ H2↑+ Cl2↑ H2↑+ Cl2↑ |
B.用银氨溶液检验乙醛中的醛基:CH3CHO +2Ag(NH3)2+ + 2OH- CH3COO- + NH4+ +3NH3 + 2Ag↓+ H2O CH3COO- + NH4+ +3NH3 + 2Ag↓+ H2O |
C.苯酚钠溶液中通入少量CO2:CO2 + H2O + 2C6H5O- 2C6H5OH + 2CO32- 2C6H5OH + 2CO32- |
D.Na与乙醇反应:Na+CH3CH2OH CH3CH2ONa +H2↑ CH3CH2ONa +H2↑ |
北京奥运会期间对大量盆栽鲜花施用了S-诱抗素制剂,以保证鲜花盛开,S-诱抗素的分子结构如图,则该分子含有的官能团为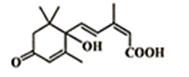
| A.羟基、羰基、羧基、酯基 |
| B.苯环、羟基、羰基、羧基 |
| C.碳碳双键、羟基、羰基、羧基 |
| D.碳碳双键、苯环、羟基、羰基 |