用惰性电极电解下列溶液,一段时间后,再加入一定质量的另一物质(中括号内),溶液能与原来溶液完全一样的是
| A.CuCl2[CuCl2溶液] | B.AgNO3[Ag2O] |
| C.NaCl [HCl溶液] | D.CuSO4[Cu(OH)2] |
下列说法全不正确的是
①CH3—CH=CH2和CH2=CH2的最简式相同
②CH≡CH和C6H6含碳量相同
③丁二烯和丁烯为同系物 ④、正戊烷、异戊烷、新戊烷的沸点逐渐变低
⑤标准状况下,11.2L的戊烷所含的分子数为0.5 NA (NA为阿伏伽德罗常数)
⑥能够快速、微量、精确的测定相对分子质量的物理方法是核磁共振谱法
| A.①②⑥ | B.②③④ | C.②③⑥ | D.③⑤⑥ |
某炔烃经催化加氢后得到2-甲基丁烷,该炔烃是
| A.2-甲基-1-丁炔 | B.2-甲基-3-丁炔 | C.3-甲基-1-丁炔 | D.3-甲基-2-丁炔 |
有机物 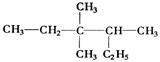 的正确命名为
的正确命名为
| A.2-乙基-3,3-二甲基-4-乙基戊烷 | B.3,3-二甲基-4-乙基戊烷 |
| C.3,3,4-三甲基已烷 | D.2,3,3-三甲基已烷 |
现有一瓶A和B的混合液,已知A和B的某些性质如下:
| 物质 |
分子式 |
熔点℃ |
沸点℃ |
密度g?cm-3 |
水溶性 |
| A |
C3H6O2 |
-98 |
57.5 |
0.93 |
可溶 |
| B |
C4H8O2 |
-84 |
77 |
0.90 |
可溶 |
由此,分离A和B的最佳方法是
A.萃取B.蒸馏C.升华D.分液
用惰性电极电解M(NO3)x的水溶液,当阴极上增重a g时,在阳极上同时产生b L气体(标准状况),
从而可知M的相对原子质量为
A.B.C.D.