一定温度下的难溶电解质AmBn在水溶液中达到溶解平衡时,已知数据如表所示:
| 物质 |
Fe(OH)2 |
Cu(OH)2 |
Fe(OH)3 |
| Ksp/25℃ |
8.0×10-16 |
2.2×10-20 |
4.0×10-38 |
| 完全沉淀时的pH范围 |
≥9.6 |
≥6.4 |
3~4 |
对含等物质的量的CuSO4、FeSO4、Fe2(SO4)3的溶液的说法,比较合理的是
A.向该混合溶液中加入少量铁粉即能观察到红色固体析出
B.向该混合溶液中逐滴加入NaOH溶液,最先看到蓝色沉淀
C.该混合溶液中c(SO42-)∶[c(Cu2+)+c(Fe2+)+c(Fe3+)]>5∶4
D.向该混合溶液中加入适量氨水,并调节pH为3~4,然后过滤,可得到纯净的CuSO4溶液
下列反应中能表示氨既有还原性又有碱性的是()
| A.NH3+HNO3====NH4NO3 |
B.2NH3+3Mg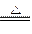 Mg3N2+3H2 Mg3N2+3H2 |
| C.8NH3+3Cl2====N2+6NH4Cl |
D.4NH3+5O2 4NO+6H2O 4NO+6H2O |
下列化学方程式中配平正确的是()
| A.H2O2+2KMnO4+3H2SO4====2MnSO4+3O2↑+K2SO4+4H2O |
| B.5H2O2+2KMnO4+3H2SO4====2MnSO4+5O2↑+K2SO4+8H2O |
| C.8H2O2+4KMnO4+2H2SO4====4MnO2+7O2↑+2K2SO4+10H2O |
| D.3H2O2+2KMnO4+3H2SO4====4O2↑+K2SO4+2MnSO4+6H2O |
在5NH4NO3 2HNO3+4N2+9H2O反应中,发生氧化反应的氮原子与发生还原反应的氮原子的物质的量之比是()
2HNO3+4N2+9H2O反应中,发生氧化反应的氮原子与发生还原反应的氮原子的物质的量之比是()
| A.5∶8 | B.5∶4 | C.5∶3 | D.3∶5 |
下列反应不属于氧化还原反应的是()
| A.CO2通入NaOH溶液中 | B.Cl2通入NaOH溶液中 |
| C.NO2通入水中 | D.FeCl3溶液溶解Cu片 |
在含有Cu(NO3)2、Zn(NO3)2、Fe(NO3)3、AgNO3各0.1 mol的混合溶液中加入0.1 mol铁粉,充分搅拌后,Fe溶解,溶液中不存在Fe3+离子,同时析出0.1 mol Ag。下列结论错误的是()
| A.氧化性:Zn2+>Cu2+>Fe3+>Ag+ | B.Fe3+的氧化性大于Cu2+ |
| C.溶液中Cu2+与Fe2+物质的量比为1∶2 | D.1 mol Fe可还原2 mol Fe3+ |