下列实验操作或记录正确的是
| A.用两只250 mL的容量瓶配制0.1 mol/L 500 mL的NaOH溶液 |
| B.用量筒测得排水法收集制得的氢气体积为50.28 mL |
| C.常温常压下测得1 mol N2的质量为28 g |
| D.用托盘天平称得2.50 g胆矾,受热充分失水后,固体质量减轻0.90 g |
被誉为“太空金属”的钛,在室温下,不与水、稀硫酸、稀盐酸和稀硝酸作用,但易溶于氢氟酸,其原因可能是()
| A.氢氟酸的酸性比其他酸强 |
| B.氢氟酸的氧化性比其它酸强 |
| C.钛离子易与氟离子形成可溶性难电离物质 |
| D.氢氟酸的还原性比其它酸强 |
下列有关化学用语表示正确的是()
A.甲基的电子式: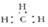 |
B.镁离子的结构示意图: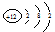 |
C.硝基苯的结构简式: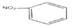 |
D.质量数为34、中子数为18的核素: |
化学与人类生产和生活密切相关,下列说法正确的是()
| A.聚乙烯塑料的老化是由于发生了加成反应 |
| B.加碘食盐中加入的I2有利于防止地方缺碘病 |
| C.汽车尾气污染物中含有氮的氧化物,是汽油不完全燃烧造成的 |
| D.二氧化硫有漂白性,常用作棉、麻、纸张的漂白 |
CuCl是难溶于水的白色固体,是一种重要的催化剂。工业上,由孔雀石(主要成分Cu(OH)2·CuCO3,含FeS、FeO和SiO2杂质)制备CuCl的某流程如下: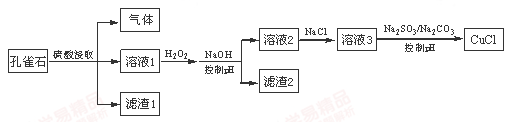
下列说法不正确的是
| A.H2O2将溶液1中Fe2+氧化为Fe3+,再通过控制pH转化为Fe(OH)3除去 |
| B.SO32-将溶液3中的Cu2+还原,反应得到CuCl |
| C.CO32-作用是控制溶液pH,促使CuCl沉淀的生成 |
| D.若改变试剂加入顺序,将溶液3缓慢加入到含大量SO32-/CO32-的溶液中,同样可制取CuCl |
下列说法正确的是
| A.对于相同浓度的弱酸HX和HY(前者的Ka较小)溶液,加水稀释相同倍数时,HY溶液的pH改变值小于HX溶液的pH改变值 |
| B.在NH3·H2O和NH4Cl浓度均为0.1 mol·L-1的体系中,外加少量酸或碱时,溶液的pH可保持基本不变 |
| C.在NaH2PO4水溶液中存在关系:c(H3PO4) + c(H+) = c(HPO42-) + c(PO43-) + c(OH-) |
D.沉淀溶解平衡AgI Ag+ + I-的平衡常数为8.5×10-17,说明难溶盐AgI是弱电解质 Ag+ + I-的平衡常数为8.5×10-17,说明难溶盐AgI是弱电解质 |