已知常温下在溶液中可发生如下两个离子反应:
Ge4++Fe2+=Fe3++Ge3+①;Sn2++2Fe3+=2Fe2++Sn4+②
由此可以确定Fe2+、Ge3+、Sn2+三种离子的还原性由强到弱的顺序是
| A.Sn2+、Fe2+、Ge3+ | B.Sn2+、Ge3+、Fe2+ |
| C.Ge3+、Fe2+、Sn2+ | D.Fe2+、Sn2+、Ge3+ |
三氧化二镍(Ni2O3)可用于制造高能电池,其电解法制备过程如下:用NaOH调NiCl2溶液pH至7.5,加放适量硫酸钠后进行电解。电解过程中产生的Cl2在弱碱性条件下生成ClO-,把二价镍氧化为三价镍。以下说法正确的是()
| A.可用铁作阳极材料 |
| B.电解过程中阳极附近溶液的pH升高 |
| C.阳极反应方程式为:4OH- - 4e- =O2↑ +2H2O |
| D.1mol二价镍全部转化为三价镍时,外电路中通过了1mol电子。 |
下列各组混合物的分离或提纯方法不正确的是()
| A.用渗析分离Fe(OH)3胶体和FeCl3的混合物 |
| B.用结晶法提纯NaCl和KNO3中的KNO3 |
| C.用蒸馏法分离乙醇和苯酚的混合物(苯酚的沸点182℃) |
| D.用加热法分离碘和氯化铵的混合物 |
将15.6g Na2O2和5.4gAl同时放入一定量的水中,充分反应后得到200ml溶液,再向该溶液中缓慢通入标准状况下的HCl气体6.72L,若反应过程中溶液的体积保持不变,则()
| A.反应过程中得到6.72L气体(标况) |
| B.最终得到的溶液中:C(Na+)=C(Cl-)+C(OH-) |
| C.最终得到的溶液中:C(NaCl)=1.5mol/L |
| D.最终得到15.6g沉淀 |
某密闭容器中发生如下反应:X(g)+3Y(g) 2Z(g);ΔH<0。下图表示该反应的速率(v)随时间(t)变化的关系,t2.t3.t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是()
2Z(g);ΔH<0。下图表示该反应的速率(v)随时间(t)变化的关系,t2.t3.t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是()
| A.t2时增加了X的浓度 | B.t3时增大了压强 |
| C.t5时升高了温度 | D.t4~t5时间内转化率最大 |
化学用语是学习化学的重要工具。下列用来表示物质变化的化学用语中正确的是()
| A.K37ClO3与浓HCl在加热条件下生成Cl2的化学方程式: K37ClO3+6HCl=K37Cl+3Cl2↑+3H2O |
B.表示H2燃烧热的热化学方程式: H2(g)+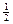 O2(g)=H2O(g);△H= -241.8KJ/mol O2(g)=H2O(g);△H= -241.8KJ/mol |
| C.将1~2ml FeCl3饱和溶液滴入到20ml沸水中所发生的离子方程式: Fe3++3H2O  Fe(OH) 3(胶体)+3H+ Fe(OH) 3(胶体)+3H+ |
| D.在Ba(OH) 2溶液中滴入硫酸氢钠至中性: Ba2++OH-+H++SO42-=BaSO4↓+ H2O |