水体污染物有:I含盐酸的酸性废水,II油类、氰化物、硫化物,III重金属离子;污水处理的化学方法有:a中和法,b氧化还原法,c沉淀法。所采用的方法对水体污染物处理不正确的是
| A.I→a | B.I→b | C.II→b | D.III→c |
下列实验设计能够成功的是
A.检验亚硫酸钠试样是否变质:试样 沉淀不溶解 沉淀不溶解 |
B.除去乙酸乙酯中混有的乙酸:混合液 得上层液体 得上层液体 |
C.证明酸性条件下H2O2氧化性比I2强: NaI溶液 溶液变蓝色 溶液变蓝色 |
| D.鉴定盐A的成分是FeBr2: |

某氯碱厂利用废铁皮制取净水剂FeCl3溶液,最合理的生产途径是
下列实验操作正确的是
| A.可用氨水除去试管内壁上的银镜 |
| B.硅酸钠溶液应保存在带玻璃塞的试剂瓶中 |
| C.将三氯化铁溶液蒸干,可制得无水三氯化铁 |
| D.锌与稀硫酸反应时,要加大反应速率可滴加少量硫酸铜 |
一定温度下,向体积为2L的密闭容器中充入1mol PCl5(g),发生反应:
PCl5(g)  PCl3(g) +Cl2(g)△H=+Qkj.mol-1维持容器温度不变,测得容器内压强随反应时间的变化如图5所示。下列说法正确的是
PCl3(g) +Cl2(g)△H=+Qkj.mol-1维持容器温度不变,测得容器内压强随反应时间的变化如图5所示。下列说法正确的是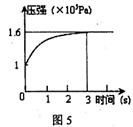
| A.3s内的平均速率为:v(PCl3)="0.1" mol·L-1.s-1 |
| B.达到平衡时放出0.6Q kJ热量 |
| C.其他条件不变,升高温度,平衡常数减小 |
| D.其他条件不变,再向容器中充入1mol PCl5(g),则达新平衡时,c(PCl5)>0.4mol·L-1 |
下列有关电解质溶液中微粒的物质的量浓度关系正确的是
A. 常温下,向醋酸钠溶液中滴加盐酸至溶液呈中性一定有:c(CH3COOH)= c(Cl-)
B.某酸式盐NaHA溶液中一定有:c(OH-)+c(A2-)= c(H+)+c(H2A)
C.NaHS04溶液中滴加Ba(OH)2至溶液恰好呈中性:c(Na+)>c(SO42一)>c(OH一)=c(H+)
D. 常温下,将50mLO.l mol.L-1的盐酸与lOOmLO.1 mol.L-1的氨水混合,所得溶液中:.
c(NH3·H20)>c(Cl一)>c(NH4+)> c(OH-)>c(H+)