用固体NaOH配制物质的量浓度溶液时,下列操作会导致溶液浓度偏高的是( )
| A.在烧杯中溶解时,有少量液体溅出 | B.样品中含有少量Na2O杂质 |
| C.容量瓶使用前未干燥 | D.定容时仰视视容量瓶刻度线 |
胆结石的形成原因分为两种,一种为无机钙型,一种为胆固醇型,前者需要手术治疗,后者则有人设计用甲基叔丁基醚制成针剂,注射病灶部位后,适时再将此处液体抽取出来,请回答:在用甲基叔丁基醚治疗胆固醇型结石的过程中,甲基叔丁基醚对胆固醇型胆结石的作用是
| A.溶解 | B.变性 | C.氧化 | D.分解为气体 |
如图,下列曲线是某环境监测小组描绘的某市中心空气中NOx含量变化曲线,横坐标表示北京时间0时至24时,纵坐标表示NOx含量,其中比较符合实际的是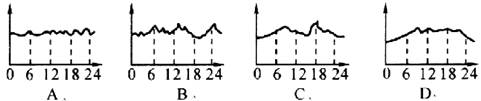
某工厂排放的酸性废水中含有较多的Cu2+,对农作物和人畜都有害,欲采用化学法除去有害成分,最好是加入下列物质中的
| A.食盐、硫酸 | B.胆矾、石灰水 |
| C.铁粉、生石灰 | D.苏打、盐酸 |
油炸虾条、薯片等容易挤碎的食品,不宜选用真空袋装,而应采用充气袋装。下列气体中最不应该充入的是
| A.氮气 | B.二氧化碳 | C.空气 | D.氧气 |
下列各组名词或现象中,三者间没有逐级因果关系的是
| A.汽车尾气-------光化学污染-------咳嗽和气喘者增多 |
| B.含磷洗衣粉-------水体富营养化-------水栖生物大量死亡 |
| C.人口增多-------空气中CO2浓度增大-------温室效应 |
| D.氟氯烃-------臭氧空洞-------皮肤癌患者增多 |