下列说法正确的是( )
A.将0.2mol/L某强碱弱酸盐NaA溶液与0.1mol/L盐酸等体积混合,混合后溶液显碱性,则混合溶液中c(HA) >c(Cl-) >c(A-)>c(OH-)
B.相同条件下,向氨水、氢氧化钠溶液中分别加入适量的氯化铵晶体后,两溶液的pH:前者减小,后者增大
C.室温条件下,将pH=3盐酸VaL与pH=11氢氧化钠溶液VbL混合,混合后溶液pH=4,假设混合后忽略体积变化,则Va∶Vb=10∶9。
D.0.1mol/L pH为4的NaHB溶液中:c(HB-)>c(H2B)>c(B2-)
在给定条件下,下列加点的物质在化学反应中完全消耗的是
| A.用50 mL 12 mol/L的氯化氢水溶液与足量二氧化锰共热制取氯气 |
| B.常温下,将1 g铝片投入20 mL 18.4 mol/L的硫酸中 |
| C.向100 mL 3 mol/L的稀硝酸中加入5.6 g铁 |
| D.常温常压下,0.1 mol氯气通入1 L水中反应 |
MCFC型燃料电池可同时供应电和水蒸气,其工作温度为600~700 ℃,所用燃料为H2,电解质为熔融的K2CO3。该电池的总反应式为:2H2 + O2=2H2O,负极反应为:H2 + CO32—— 2e—=H2O + CO2。则下列推断中,正确的是
| A.正极反应为4OH—— 4e— = 2H2O+O2↑ | B.放电时CO32— 向负极移动 |
| C.当生成1 mol水时,转移4 mol电子 | D.通H2的一极为负极,发生还原反应 |
“封管实验”具有简易、方便、节约、绿色等优点,观察下面四个“封管实验”(夹持装置未画出),判断下列说法正确的是
| A.加热时,①上部汇集了固体NH4Cl,说明NH4Cl的热稳定性比较好 |
| B.加热时,②、③溶液均变红,冷却后又都变为无色 |
| C.④中,浸泡在热水中的容器内气体颜色变深,浸泡在冰水中的容器内气体颜色变浅 |
| D.四个“封管实验”中所发生的化学反应都是可逆反应 |
常温下,将等质量的铜片、银片、铁片、锌片分别置于四个小烧杯中,然后分别加足量的浓硝酸,放出NO2气体最多的是
| A.铜片 | B.银片 | C.铁片 | D.锌片 |
下图所示的电解池I和II中,a、b、c和d均为Pt电极。电解过程中,电极b和d上没有气体逸出,但质量均增大,且增重b>d。符合上述实验结果的盐溶液是 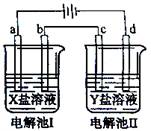
| 选项 |
X |
Y |
| A. |
MgSO4 |
CuSO4 |
| B. |
AgNO3 |
CuSO4 |
| C. |
FeSO4 |
Al2 (SO4)3 |
| D. |
CuSO4 |
AgNO3 |