某有机物的分子结构如下所示:CH3- -CH=CH-C≡C-CH3,该分子中最多可以有多少个原子共面( )
-CH=CH-C≡C-CH3,该分子中最多可以有多少个原子共面( )
| A.18 | B.20 | C.22 | D.24 |
25℃、101kPa下:①2Na(s)+ O2(g)=Na2O(s)△H=﹣414kJ•mol﹣1②2Na(s)+O2(g)=Na2O2(s)△H=﹣511kJ•mol﹣1下列说法正确的是()
O2(g)=Na2O(s)△H=﹣414kJ•mol﹣1②2Na(s)+O2(g)=Na2O2(s)△H=﹣511kJ•mol﹣1下列说法正确的是()
| A.①和②产物的阴阳离子个数比不相等 |
| B.①和②生成等物质的量的产物,转移电子数不同 |
| C.常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快 |
| D.25℃、101kPa下:Na2O2(s)+2Na(s)=2Na2O(s)△H=﹣317kJ•mol﹣1 |
纽扣电池的两极材料分别为锌和氧化银,电解质溶液为KOH溶液.放电时两个电极反应分别为:Z n+2OH﹣→Zn(OH)2+2e﹣Ag2O+H2O+2e﹣→2Ag+2OH﹣下列说法正确的是()
| A.溶液中OH﹣向正极移动,K+、H+向负极移动 |
| B.锌发生还原方应,氧化银发生还原反应 |
| C.锌是负极,氧化银是正极 |
| D.在电池放电过程中,电解质溶液的酸碱性基本保持不变 |
研究人员最近发现了一种“水”电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl,下列“水”电池在海水中放电时的有关说法正确的是()
| A.正极反应式:Ag+Cl﹣﹣e﹣=AgCl |
| B.每生成1mol Na2Mn5O10转移2mol电子 |
| C.Na+不断向“水”电池的负极移动 |
| D.AgCl是还原产物 |
把铁钉和碳棒用导线连接起来后浸入食盐溶液中,可能出现的现象是()
| A.铁钉上放出氢气 | B.铁钉锈蚀 | C.碳棒上放出氯气 | D.碳棒上放出氧气 |
如图为直流电源电解稀Na2SO4水溶液的装置,通电后在石墨电极a和b附近分别滴加石蕊溶液,下列实验现象正确的是()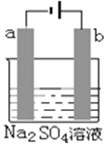
| A.逸出气体的体积:a电极的小于b电极的 |
| B.a电极附近呈蓝色,b电极附近呈红色 |
| C.a电极附近呈红色,b电极附近呈蓝色 |
| D.电极逸出无味气体,另一电极逸出刺激性气味气体 |