世界上60%的镁是从海水中提取的,其主要步骤如下:
①把贝壳制成生石灰;②在海水中加入生石灰,过滤,洗涤沉淀物;③将沉淀物与盐酸反应,结晶、过滤;④在氯化氢热气流中加热晶体;⑤电解上述所得盐(熔融条件下)。下列说法中,不正确的是( )
| A.向最后一次洗涤液中滴加碳酸钠溶液可检验沉淀是否洗涤干净 |
| B.上述变化过程中包括了分解、化合、复分解三种反应类型 |
| C.步骤⑤也可以采用电解该盐水溶液的方法 |
| D.为节省原料、减少污染,在提取镁的工业流程中使用了物质循环的过程 |
下列关于反应能量的说法正确的是
| A.相同条件下,如果1 mol氢原子所具有的能量为E1,1 mol 氢分子所具有的能量为E2,则2E1=E2 |
| B.Zn(s)+CuSO4(aq)===ZnSO4(aq)+Cu(s) ΔH=-216 kJmol-1,则反应物总能量>生成物总能量 |
| C.101 kPa时,2H2(g)+O2(g)="==2H2O(l)" ΔH=-571.6 kJmol-1,则H2的燃烧热为571.6 kJmol-1 |
| D.H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJmol-1,则1 mol NaOH的氢氧化钠固体与含0.5 mol H2SO4的稀硫酸混合后放出57.3 kJ的热量 |
下列离子能大量共存于同一溶液中的是
| A.Na+、HCO3-、Cl-、NO3- |
| B.K+、Fe3+、SCN-、SO42- |
| C.K+、H+、ClO-、Cl- |
| D.K+、Na+、S2-、Al3+ |
恒温、恒压下,反应N2 (g)+3H2 (g) 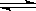 2NH3 (g)从两条途径分别建立平衡:
2NH3 (g)从两条途径分别建立平衡:
Ⅰ.N2、H2的起始浓度分别为1 mol / L和3 mol / L;
Ⅱ.NH3的起始浓度为4 mol / L。下列有关叙述不正确的是:
| A.途径Ⅰ与途径Ⅱ所得混合气体的百分组成相同 |
| B.途径Ⅰ的平衡速率v (N2)与途径Ⅱ的平衡速率v (NH3)的比值为1∶2 |
| C.途径Ⅰ所得NH3的浓度与途径Ⅱ所得NH3的浓度之比为1∶2 |
| D.途径Ⅰ与途径Ⅱ所得平衡混合气体的物质的量之比为1∶2 |
250℃和1.01105Pa时,反应:2N2O5(g)="4NO2(g)+O2(g)" △H=+56.76kJ/mol,自发进行的原因是
| A.是吸热反应 | B.是放热反应 |
| C.是熵减少的反应 | D.熵效应大于焓效应 |
下列叙述错误的是
| A.从FeCl3固体出发配制其溶液时,应先将FeCl3固体溶解在一定浓度的盐酸溶液中,然后再稀释到所需要的浓度 |
B.Al3+的水解方程式为 Al3+ + 3H2O Al(OH)3 + 3H+ Al(OH)3 + 3H+ |
| C.NaHSO4在水溶液中的电离方程式为 NaHSO4 =" Na+" + H+ + SO42- |
| D.H2CO3的电离方程式为 H2CO3 =" H+" + HCO3- |