灰锡(以粉末状存在)和白锡是锡的两种同素异形体。
已知:①Sn(s,白)+2HCl(aq)=SnCl2(aq)+H2(g) ΔH1
②Sn(s,灰)+2HCl(aq)=SnCl2(aq)+H2(g) ΔH2
③Sn(s,灰)  Sn(s,白) ΔH3=+2.1 kJ·mol-1
Sn(s,白) ΔH3=+2.1 kJ·mol-1
下列说法正确的是 ( )
| A.ΔH1>ΔH2 |
| B.锡在常温下以灰锡状态存在 |
| C.灰锡转化为白锡的反应是放热反应 |
| D.锡制器皿长期处在低于13.2 ℃的环境中,会自行毁坏 |
元素X的原子核外M电子层上有3个电子,元素Y2-的离子核外有18个电子,则这两种元素可形成的化合物为()
| A.XY2 | B.X2Y3 | C.X3Y2 | D.XY2 |
地球一小时是世界自然基金会应对全球气候变化所提出的一项倡议,以此来激发人们对保护地球的责任感,同时倡导节能减排理念。下列不能达到节能减排目的的是()
| A.利用太阳能分解水获得氢气 | B.用家用汽车代替公交车 |
| C.利用化石燃料制造燃料电池 | D.在农村推广建造沼气池 |
观察下列模型并结合有关信息,判断有关说法正确的是
| 硼晶体的结构单元 |
SF6分子 |
S8分子 |
NaCl |
|
| 结构模型示意图 |
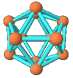 |
 |
 |
 |
| 备注 |
熔点1873K |
/ |
易溶于CS2 |
/ |
A.单质硼属分子晶体,其结构单元B12中含有30个B-B键,含20个正三角形
B.SF6是由极性键构成的分子
C.固态硫S8属于原子晶体
D.NaCl熔化和溶于水均能产生自由移动的离子,且破坏的是同种作用力,NaCl晶胞中每个Na+周围最近且等距离的Na+有6个
现有四种元素的基态原子的电子排布式如下:
①1s22s22p63s23p4②1s22s22p63s23p3③1s22s22p3④1s22s22p5
则下列有关比较中正确的是
| A.第一电离能:④>③>②>① |
| B.原子半径:④>③>②>① |
| C.电负性:④>③>②>① |
| D.最高正化合价:④>③=②>① |
下列现象与氢键有关的是:
①水结成冰体积膨胀,密度变小
②水加热到很高温度都难以分解
③HF、HCl、HBr、HI的热稳定性依次减弱
④对羟基苯甲醛的沸点高于邻羟基苯甲醛
⑤Cl2、Br2、I2单质熔点随相对分子质量增大而升高
⑥NH3极易溶于水中
| A.①④⑥ | B.①②③④⑤ | C.①④ | D.①②③ |