将甲、乙两种金属的性质相比较,已知①甲跟水反应比乙跟水反应剧烈;②甲单质能从乙的盐溶液中置换出乙单质;③甲的最高价氧化物对应水化物的碱性比乙的最高价氧化物对应水化物的碱性强;④与某金属反应时甲原子得电子数目比乙的多;⑤以甲、乙两金属为电极构成原电池,甲作负极。能说明甲的金属性比乙强的是( )
| A.①②③ | B.③⑤ | C.①②③⑤ | D.①②③④⑤ |
在298 K、1.01×105 Pa下,将22 g CO2通入750 mL 1 mol·L-1 NaOH溶液中充分反应,测得反应放出x kJ的热量。已知在该条件下,1 mol CO2通入1 L 2 mol·L-1 NaOH溶液中充分反应放出y kJ的热量。则CO2与NaOH溶液反应生成NaHCO3的热化学方程式为( )。
| A.CO2(g)+NaOH(aq)===NaHCO3(aq) ΔH=-(2y-x) kJ·mol-1 |
| B.CO2(g)+NaOH(aq)===NaHCO3(aq) ΔH=-(2x-y) kJ·mol-1 |
| C.CO2(g)+NaOH(aq)===NaHCO3(aq) ΔH=-(4x-y) kJ·mol-1 |
| D.CO2(g)+NaOH(aq)===NaHCO3(aq) ΔH=-(8x-2y) kJ·mol-1 |
近来报道,含镍烤瓷牙可能导致人体出现不良反应。粗镍中含有少量杂质Fe、Zn、Cu、Pt,可用电解法制备高纯度的镍(已知氧化性:Fe2+<Ni2+<Cu2+),下列叙述正确的是
| A.阳极发生还原反应,其电极反应式为Ni2++2e-===Ni |
| B.电解后,电解槽底部的阳极泥中只有Cu和Pt |
| C.电解后,溶液中存在的阳离子只有Fe2+和Zn2+ |
| D.电解过程中,阳极质量的减少与阴极质量的增加相等 |
下列推论正确的是
| A.S(g)+O2(g)===SO2(g) ΔH=a ;S(s)+O2(g)===SO2(g) ΔH=b;则a>b |
| B.C(石墨)===C(金刚石) ΔH=1.9 kJ·mol-1,则可判定金刚石比石墨稳定 |
| C.NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l) ΔH=-57.3 kJ·mol-1,则含20 g NaOH的稀溶液与稀盐酸完全反应,放出的热量为28.7 kJ |
| D.CaCO3(s)===CaO(s)+CO2(g) ΔH>0,则该反应任何温度下都能自发进行 |
下列叙述不正确的是
| A.电镀时,应把镀件置于电解槽的阴极,电镀液应含有镀层金属的阳离子 |
| B.中国第1艘液化天然气船“大鹏昊”船底镶嵌锌块,锌作负极,可以防止船体被腐蚀 |
| C.电解水的过程中,阴极区附近的溶液的pH会降低 |
| D.将钢铁与电源的负极相连可以起到保护钢铁的作用 |
结合下图判断,下列叙述正确的是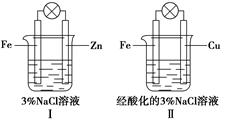
| A.Ⅰ和Ⅱ中正极均被保护 |
| B.Ⅰ和Ⅱ中负极反应均是Fe-2e-="==" Fe2+ |
| C.Ⅰ和Ⅱ中正极反应均是O2+2H2O+4e-="==" 4OH- |
| D.Ⅰ和Ⅱ中灯泡均会发亮 |