今有如下三个热化学方程式:
H2(g)+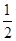 O2(g)=H2O(g);△H=" a" kJ/mol
O2(g)=H2O(g);△H=" a" kJ/mol
H2(g)+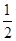 O2(g)=H2O(l);△H=" b" kJ/mol
O2(g)=H2O(l);△H=" b" kJ/mol
2H2(g)+ O2(g)=2H2O(l);△H=" c" kJ/mol
关于它们的下列表述,正确的是
| A.它们都是吸热反应 | B.a、b和c均为正值 |
| C.反应热的关系:a=b | D.反应热的关系:2b=c |
可逆反应:2NO2 2NO+O2 在密闭容器中反应,达到平衡状态的标志是( )
2NO+O2 在密闭容器中反应,达到平衡状态的标志是( )
①单位时间内生成n molO2的同时生成2n molNO2
②单位时间内生成n molO2的同时,生成2n mol NO
③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2 : 2 : 1的状态
④混合气体的颜色不再改变的状态⑤混合气体的密度不再改变的状态
| A.①④ | B.②③⑤ | C.①③④ | D.①②③④⑤ |
用铂电极(惰性)电解下列溶液时,阴极和阳极上的主要产物分别是H2和O2的是( )
| A.NaCl溶液 | B.HCl溶液 | C.稀NaOH溶液 | D.AgNO3溶液 |
下列各组热化学方程式程中,△H的绝对值前者大于后者的是( )
①C(s)+O2(g)=CO2(g);△H1 C(s)+1/2O2(g)=CO(g);△H2
②S(s)+O2(g)=SO2(g);△H3 S(g)+O2(g)=SO2(g);△H4
③H2(g)+1/2O2(g)=H2O(g);△H52H2(g)+O2(g)=2H2O(l);△H6
| A.① | B.② | C.②③ | D.①②③ |
一个原电池的总反应的离子方程式是Zn+Cu2+ ="==" Zn2+ + Cu,该反应的原电池的正确组成是( )
| A |
B |
C |
D |
|
| 正极 |
Zn |
Cu |
Zn |
Fe |
| 负极 |
Cu |
Zn |
Ag |
Zn |
| 电解质溶液 |
CuCl2 |
H2SO4 |
CuSO4 |
CuCl2 |
在化学反应A(g)+3B(g) 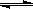 2C(g)+D(g)中,各物质的平均反应速率间的关系式正确的是( )
2C(g)+D(g)中,各物质的平均反应速率间的关系式正确的是( )
| A.vA=vB | B.vA=2vC | C.vB=3vD | D.3vB=vC |