向某密闭容器中加入0.3 mol A、0.1 mol C和一定量的B三种气体。一定条件下发生反应,各物质的浓度随时间变化如甲图所示[t0~t1阶段的c(B)变化未画出]。乙图为t2时刻后改变条件平衡体系中正、逆反应速率随时间变化的情况,且四个阶段都各改变一种反应条件且互不相同,t3~t4阶段为使用催化剂。下列说法中正确的是
A.若t1=15 s,用A的浓度变化表示t0~t1阶段的平均反应速率为0.004 mol·L-1·s-1
B.该容器的容积为2 L,B的起始物质的量为0.02 mol
C.t4~t5阶段改变的条件一定为减小压强
D.t5~t6阶段,容器内A的物质的量减少了0.06 mol,而此过程中容器与外界的热交换总量为a kJ,该反应的热化学方程式:3A(g) B(g)+2C(g) ΔH=-50a kJ·mol-1
B(g)+2C(g) ΔH=-50a kJ·mol-1
同温同压下,等质量的SO2与SO3相比较,下列叙述正确的是
| A.含氧原子个数比为2∶3 |
| B.含氧原子个数比为5∶6 |
| C.含硫原子个数比为3∶4 |
| D.含硫元素质量比为5∶4 |
关于酸、碱、盐的定义,下列各种说法中正确的是
| A.化合物电离出的阳离子有氢离子的就是酸 |
| B.化合物电离出的阴离子有氢氧根离子的就是碱 |
| C.盐电离出的阳离子不一定都是金属阳离子 |
D.NH4Cl电离的电离方程式是NH4Cl====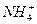 +Cl-,NH4Cl属于盐 +Cl-,NH4Cl属于盐 |
设 NA表示阿伏加德罗常数,下列说法不正确的是
| A.常温常压下,11.2 L氧气所含的原子数为NA |
B.1.8 g 的 中含有的电子数为NA 中含有的电子数为NA |
| C.常温常压下,48 g O3含有的氧原子数为3NA |
| D.2.4 g金属镁变为镁离子时失去的电子数为0.1NA |
能正确表示下列反应的离子方程式的是
A.Ba(OH)2与稀H2SO4反应 Ba2++OH-+H++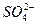 ====BaSO4↓+H2O ====BaSO4↓+H2O |
B.饱和碳酸钠溶液中通入足量CO2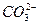 +H2O+CO2====2 +H2O+CO2====2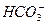 |
| C.Cl2与NaOH溶液反应 Cl2+2OH-====Cl-+ClO-+H2O |
| D.把金属铁放入稀硫酸中 2Fe+6H+====2Fe3++3H2↑ |
欧盟国家规定禁用水银温度计,因为它在使用时易破碎,泄漏的水银危害人体健康,水银属于
| A.化合物 | B.混合物 | C.氧化物 | D.单质 |