美国化学家R.F.Heck因发现如下Heck反应而获得2010年诺贝尔化学奖。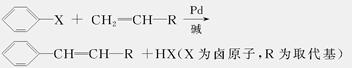

回答下列问题:
(1)C与浓H2SO4共热生成F,F能使酸性KMnO4溶液褪色,F的结构简式______。D在一定条件下反应生
成高分子化合物G,G的结构简式是___________________________。
(2)在A→B的反应中,检验A是否反应完全的试剂是_______________________________。
(3)E的一种同分异构体K符合下列条件:苯环上有两个取代基且苯环上只有两种不同化学环境的氢,与FeCl3溶液作用显紫色。K与过量NaOH溶液共热,发生反应的方程式为_________________________________________________________________________。
下图是用铅蓄电池为电源,模拟氯碱工业电解饱和食盐水的装置图(C、D均为石墨电极)。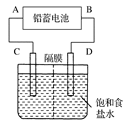
已知:铅蓄电池在放电时发生下列电极反应
负极 Pb+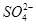 -2e-===PbSO4
-2e-===PbSO4
正极 PbO2+4H++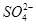 +2e-===PbSO4+2H2O
+2e-===PbSO4+2H2O
(1)请写出电解饱和食盐水的化学方程式。
(2)若在电解池中C极一侧滴2滴酚酞试液,电解一段时间后未呈红色,说明蓄电池的A极为________极。
(3)用铅蓄电池电解1 L饱和食盐水(食盐水足量、密度为1.15 g·cm-3)时,
①若收集到11.2 L(标准状况下)氯气,则至少转移电子________mol。
②若蓄电池消耗H2SO4 2 mol,则可收集到H2的体积(标准状况下)为________L。
甲、乙、丙为常见单质,乙、丙两元素在周期表中位于同一主族。X、A、B、C、D、E、F、G均为常见的化合物,其中A和X的摩尔质量相同,A、G的焰色反应为黄色。在一定条件下,各物质相互转化关系如图。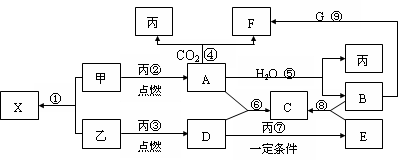
请回答:
(1) 写化学式:丙_________,E________。
(2)X的电子式为____________________。
(3) 写出A与H2O反应的化学反应方程式:__________________________ 。
(4)写出B与G溶液反应生成F的离子方程式:________________________。
(5)在上图的反应中,不属于氧化还原反应的是(填序号)______________。
在实验室我们也可以用右图所示的装置制取乙酸乙酯。回答下列问题: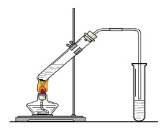
(1)在大试管中配制一定比例的乙醇、乙酸和浓硫酸的混合液的方法是:。
(2)饱和碳酸钠溶液的主要作用。
(3)装置中通蒸气的导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中,其目的是 。
(4)生成乙酸乙酯的反应是可逆反应,反应物不能完全变成生成物,反应一段时间后,就达到了该反应的限度,也即达到化学平衡状态。下列描述能说明乙醇与乙酸的酯化反应已达到化学平衡状态的有(填序号) 。
①单位时间里,生成1mol乙酸乙酯,同时生成1mol水
②单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸
③单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
④正反应的速率与逆反应的速率相等
⑤混合物中各物质的浓度不再变化
⑥混合物水中的18O的物质的量不再变化
有A、B、C、D四种短周期元素, 它们的原子序数由A到D依次增大, 已知A和C原子最外层只有一个电子,C燃烧时的焰色反应是黄色,C的单质在高温下与B的单质充分反应可以产生淡黄色固态化合物,A单质与D单质可以发生化合反应,且反应条件可以是点燃或者光照,试根据以上叙述回答:
(1)写出A、B、C、D的元素名称::A _______ B _______ C _______ D ______。
(2)写出化学方程式:
①C+B=,
②A+D=。
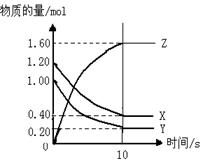
如右图所示,某温度下,物质的量分别是1.2mol的气体X和物质的量为1.0mol的气体Y,在2L密闭容器中反应生成气体Z,反应5min后测得n(X) =0.4mol,n(Y)=0.2mol,生成的n(Z)=1.6mol,则该反应的化学方程式可表示为,反应在10分钟内的化学反应速率用Z来表示则V(Z)=。