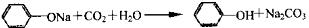工业上制备氯化铜时,是将浓盐酸用蒸气加热至80℃左右,慢慢加入粗制氧化铜粉末(含杂质氧化亚铁),充分搅拌,使之溶解,反应如下:
CuO+2HCl=CuCl2+H2O
FeO+2HCl=FeCl2+H2O
已知:pH≥9.6时,Fe2+以Fe(OH)2形式完全沉淀;pH≥6.4时,Cu2+以Cu(OH)2的形式完全沉淀;pH在3~4时,Fe3+以Fe(OH)3的形式完全沉淀.除去溶液中的Fe2+,可以采用的方法是 ( )
| A.直接加碱,调整溶液pH≥9.6 |
| B.加纯铜粉,将Fe2+还原出来 |
| C.先将Fe2+氧化成Fe3+,再调整pH在3~4 |
| D.通入硫化氢,使Fe2+直接沉淀 |
“绿色化学”对化学反应提出了“原子经济性”(原子节约) 的概念及要求。理想的“原子经济性”反应中,原料分子中的所有原子全部转变成所需产物,不产生副产物,实现零排放。以下反应中符合“原子经济性”的是()
| A.苯乙烯在一定条件下制聚苯乙烯 | B.乙醇与浓硫酸共热制乙烯 |
| C.乙醇催化氧化制乙醛 | D.乙烷与氯气反应制氯乙烷 |
某有机物的结构简式为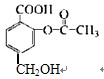 ,能与1 mol该化合物反应的NaOH的物质的
,能与1 mol该化合物反应的NaOH的物质的
量是()
| A.1 mol | B.2 mol | C.3 mol | D.4 mol |
实验室用右图所示的装置制取乙酸乙酯,下列说法正确的是()
| A.试管a中先加入浓硫酸,再加入适量的乙醇和冰醋酸,然后加热 |
| B.试管b中加入氢氧化钠溶液除去乙酸乙酯中少量的乙酸和乙醇 |
| C.及时将乙酸乙酯蒸出,平衡向生成乙酸乙酯的方向移动 |
D.用 与乙酸反应制取酸乙酸乙酯, 与乙酸反应制取酸乙酸乙酯,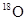 存在于水中 存在于水中 |
巴豆酸的结构简式为 。现有 ①氯化氢 ②溴水 ③纯碱溶液 ④2-丁醇 ⑤高锰酸钾酸性溶液,在一定条件下可能与巴豆酸反应的是()
。现有 ①氯化氢 ②溴水 ③纯碱溶液 ④2-丁醇 ⑤高锰酸钾酸性溶液,在一定条件下可能与巴豆酸反应的是()
| A.只有②④⑤ | B.只有①③④ |
| C.只有①②@④ | D.①②③④⑤ |
下列化学方程式正确的是()
A.甲苯与浓硝酸反应 |
B.乙酸乙酯在酸性条件下水解  |
C.乙醛与新制氢氧化铜反应 |
| D.苯酚钠溶液中通入少量二氧化碳 |