X、Y、Z、W为四种短周期主族元素,其中X、Z同族,Y、Z同周期,W是短周期主族元
素中原子半径最大的,X原子最外层电子数是核外电子层数的3倍,Y的最高正价与最低负价代数和为6。下列说法正确的是( )
| A.Y元素最高价氧化物对应的水化物化学式H2YO4 |
| B.原子半径由大到小的顺序为:Z>Y> W |
| C.X、Z两种元素的气态氢化物中,Z的气态氢化物较稳定 |
| D.X与W形成的两种化合物中,阴、阳离子物质的量之比均为1:2 |
下列关于合成氨和联合制纯碱工业生产的叙述中,正确的是()
| A.合成氨生产过程中将NH3液化分离,可加大正反应速率,提高N2、H2的转化率 |
| B.联合制碱法生产工艺中采用循环操作,其目的是提高食盐的利用率 |
| C.从氨合成塔出来的混合气体中NH3只占15%左右,所以生产氨的工厂效率都很低 |
| D.联合制碱法中关键的一步是向分离出NaHCO3晶体后的母液中不断地通入CO2 |
下列有关工业生产的叙述正确的是()
| A.合成氨生产中将NH3液化分离,可加快正反应速率,提高N2、H2的转化率 |
| B.硫酸工业中,在接触室安装热交换器是为了利用SO3转化为H2SO4时放出的热量 |
| C.电解饱和食盐水制烧碱采用离子交换膜法,可防止阴极室产生的Cl2进入阳极室 |
| D.侯氏制碱法是将氨气和二氧化碳先后通入饱和氯化钠溶液中,制得碳酸氢钠固体,再在高温下灼烧,转化为碳酸钠固体 |
下列工业生产所涉及的化学用语表达不正确是()
A.工业上制取氯气:MnO2+4HCl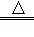 Cl2↑+MnCl2+H2O Cl2↑+MnCl2+H2O |
B.工业上合成氨:N2+3H2  2NH3 2NH3 |
C.工业上制取粗硅:SiO2+2C Si+2CO↑ Si+2CO↑ |
| D.工业上生产漂白粉:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O |
传统合成氨工业需要采用高温、高压和催化剂.近来美国化学家使用新型铁系催化剂,在常温下合成了氨气.下列说法正确的是()
| A.新型合成氨方法是吸热反应 |
| B.新型合成氨方法可简化生产设备 |
| C.新型催化剂提高了N2和H2的转化率 |
| D.两种方法中该反应的化学平衡常数相同 |
符合目前工业生产实际的化工生产原理是()
| A.合成氨工业中,由于氨易液化,N2、H2循环使用,所以总体上氨的产率很高 |
| B.氯气和氢气混合在光照条件下反应生成氯化氢,用水吸收得到盐酸 |
| C.氯碱工业中,电解槽的阳极区产生NaOH |
| D.二氧化硫在接触室被氧化成三氧化硫,三氧化硫在吸收塔内被水吸收制成浓硫酸 |