下列离子反应方程式正确的是 ( )
| A.硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液:2Fe2++2H++H2O2 = 2Fe3++2H2O |
B.电解饱和食盐水:2Cl- +2H+ H2↑+C12↑ H2↑+C12↑ |
| C.向氯化铝溶液中加入过量氨水:Al3++ 4NH3·H2O=[Al(OH)4]-+ 4NH4+ |
D.铜粉与98.3%的硫酸加热下反应:Cu + 4H+ + SO42― Cu2++ SO2↑+ 2H2O Cu2++ SO2↑+ 2H2O |
能正确表示下列化学反应的离子方程式的是
| A.金属铝溶于盐酸中:Al+2H+=Al3++H2↑ |
| B.碳酸钙溶于硝酸中:2H++CO32-=CO2↑+H2O |
| C.硫酸氢钠溶液中加入碳酸氢钠溶液:H++HCO3-=CO2↑+H2O |
| D.在澄清石灰水中通入过量的CO2:Ca2++2OH-+CO2=CaCO3↓+H2O |
已知气体的摩尔质量越小,扩散速度越快。下图所示为气体扩散速度的实验,两种气体扩散相遇时形成白色烟环。下列关于甲、乙的判断正确的是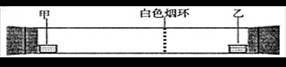
| A.甲是浓氨水,乙是浓硫酸 | B.甲是浓盐酸,乙是浓氨水 |
| C.甲是浓氨水,乙是浓硝酸 | D.甲是浓硝酸,乙是浓氨水 |
有一充有20mL NO和NO2混合气体的试管,倒置于盛有水的水槽中,充分反应后,仍有12mL无色气体,则原混合气体中NO和NO2体积比为
A 3∶2B.2∶3 C.1∶4 D.4∶1
下列是某同学对相应反应的离子方程式所作的评价,其中评价合理的是
| A.只有② | B.①③ | C.①②③④ | D.②④ |
元素X、Y可组成化学式为XY2的离子化合物,则X、Y的原子序数可能是
| A.11和16 | B.6和8 | C.12和17 | D.19和9 |