已知A、B、C、D、E五种主族元素分属三个短周期,且原子序数依次增大。A、C同主族,可形成离子化合物CA;B、D同主族,可形成DB2、DB3两种分子。请回答下列问题:
(1)元素E在元素周期表中的位置是
(2)A、B两种元素能形成两种常温下呈液态的化合物M、N,具有强氧化性的化合物M的电子式可表示为 ;化合物N在同主族元素形成有具有相同结构的物质中,具有较高的沸点,其原因是 。
(3)A、B、C、D中的三种或四种元素能形成多种离子化合物,其水溶液呈碱性的有 (写出所有化合物,用化学式表示,下同),呈酸性的有 (写出所有化合物)。
(4)元素B、E的单质或两元素之间形成的化合物可作水消毒剂的有 (写出其中两种物质的化学式)。
a、b、c、d、e、f、g为七种由短周期元素构成的粒子,它们都有10个电子,其结构特
点如下:
粒子代码:a b c d e f g
原子核数:单核单核双核多核单核多核多核
电荷数: 0 1+ 1- 0 2+ 1+ 0
(单位电荷)
其中b的离子半径大于e的离子半径;d是由极性键构成的四原子极性分子;c与f可形成两
个共价型g分子。
试写出:(1)a粒子的原子结构示意图________________________________________.
(2)b与e相应元素的最高价氧化物对应水化物的碱性强弱比较为__________>__________(用化学式表示)。
(3)d溶于水的电离方程式__________________。
(4)g粒子所构成的晶体类型属__________________。
(5)c粒子是__________________,f粒子是__________________ (用化学式表示)。
氮可以形成多种离子,如: 等。已知
等。已知 的形成过程类似于
的形成过程类似于 的形成过程,
的形成过程, 在碱性溶液中生成电中性的分子和H2O,试填写下列空白:
在碱性溶液中生成电中性的分子和H2O,试填写下列空白:
(1)该电中性分子的化学式为 。
(2) 离子的电子式为 。
离子的电子式为 。
(3)一个 离子共有 个电子。
离子共有 个电子。
(4)写出两种由多原子组成的含有与 电子数相同的粒子的化学式: 。
电子数相同的粒子的化学式: 。
氮化钠(Na3N)是科学家制备的一种重要的化合物,它与水作用可产生NH3。
请完成下列问题:
(1)Na3N是由 键形成的化合物。
(2)Na3N与盐酸反应生成 种盐。
(3)Na3N与水的反应属于 反应
a、b、c、d、e、f、g、h为8种由短周期元素构成的微粒,它们都有10个电子,其结构特点如下:
| 微粒代码 |
a |
b |
c |
d |
e |
f |
g |
h |
| 原子核个数 |
单核 |
单核 |
双核 |
多核 |
单核 |
多核 |
多核 |
多核 |
| 带电荷数(单位:电荷) |
0 |
+1 |
-1 |
0 |
+2 |
+1 |
0 |
+1 |
其中b的离子半径大于e的离子半径,d是由极性键构成的四原子极性分子;c与f可形成两个共价型g分子,d微粒和h微粒在一定条件下可互相转化,试写出:
(1)a微粒原子核外结构示意图:,c微粒电子式为。
(2)b与e相应元素的最高价氧化物对应水化物的碱性强弱比较为:>(写化学式)
(3)c微粒和f微粒反应生成2分子g的离子方程式为。
(4)大量c微粒和大量h微粒共热生成d微粒的离子反应方程式为。
(5)大量微粒g所构成的晶体属;d微粒分子结构呈;h微粒所构成的晶体中化学键的类型有 。
(18分)根据下图回答问题:
(1)A图是某离子化合物的晶胞(组成晶体的一个最小重复单位),阳离子位于中间,阴离
子位于8个顶点,该化合物中阳、阴离子的个数比是_______________。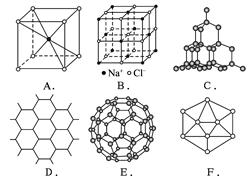
(2)B图表示构成NaCl晶体的一个晶胞,通过想像与推理,可确定一个NaCl晶胞中含Na+
和Cl-的个数分别为_______________、_______________。
(3)C图是金刚石的晶体结构,C60、金刚石和石墨三者的关系是_______________。
| A.同分异构体 | B.同素异形体 | C.同系物 | D.同位素 |
硅晶体的结构跟金刚石相似,1 mol硅晶体中含有硅硅单键的数目约是_______________NA个。二氧化硅的结构相当于在硅晶体结构中每个硅—硅单键之间插入一个氧原子。二氧化硅的空间网状结构中,硅、氧原子形成的最小环上原子数目是_______________。
(4)石墨晶体结构如D图所示,每一层由无数个正六边形构成,则平均每一个正六边形所占有的碳原子数为_______________,“C—C”键数为_______________。
(5)足球烯C60结构形如足球,如E图,则C60中有_______________个六边形,_______________个五边形。固态时,C60属于_______________ (填“离子”、“原子”或“分子”)晶体,C60分子中含有双键的数目是_______________。
(6)晶体硼的基本结构单元都是由硼原子组成的正二十面体的原子晶体,如F图。其中含有
20个等边三角形和一定数目的顶角,每个顶角上各有1个原子。试观察F图,推断这个基本结构单元所含硼原子个数、键角、“B—B”键的个数依次为______________、_______________、_______________。