X、Y、M、Z四种短周期主族元素的原子半径依次减小,X、Y、Z的电子层数之和为5,X元素原子的最外层电子数是它的电子层数的2倍,Y元素原子的最外层电子数是X和Z两元素原子最外层电子数的总和,M是地壳中含量最多的元素。下列说法不正确的是
| A.化合物YZ3极易溶解于水 |
| B.Z与M可以形成含有非极性键的化合物 |
| C.12 g14X中含有中子的物质的量为8 mol |
| D.由上述四种元素组成的离子化合物受热易分解 |
下图为原子结构模型的演变图,
⑴为道尔顿实心球式原子模型
⑵为卢瑟福行星运转式原子模型
⑶为汤姆生葡萄干面包式模型
⑷为近代量子力学原子模型
⑸为玻尔轨道式原子模型。其中合历史演变顺序的一组排列是
| A.⑴⑶⑵⑸⑷ | B.⑴⑵⑶⑷⑸ | C.⑴⑸⑶⑵⑷ | D.⑴⑶⑸⑷⑵ |
符合如下图中阴影部分的物质是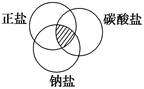
| A.Na2CO3 | B.Cu2(OH)2CO3 |
| C.NaCl | D.NaHCO3 |
下列说法不正确的是
| A.向纯水中加入盐酸使水的电离平衡逆向移动,水的离子积不变 |
| B.NH3(g)+HCl(g)==NH4Cl(s)△H<0,低于一定温度自发,高于一定温度非自发 |
| C.铅蓄电池在放电过程中,负极质量减少,正极质量增加 |
| D.用饱和Na2CO3溶液处理BaSO4沉淀,可将BaSO4转化为BaCO3 |
一种由甲醇、氧气和强碱溶液(作电解质)组成的新型手机电池,可持续使用一个月,其电池反应为: ,则有关说法正确的是
,则有关说法正确的是
| A.放电时CH3OH参与反应的电极为正极 |
| B.放电时负极的电极反应为CH3OH+8OH-→CO+6H2O+6e- |
| C.标准状况下,通入5.6 L O2并完全反应后,有0.5 mol电子转移 |
| D.放电一段时间后,通入氧气的电极附近溶液的pH降低 |
用惰性电极电解M(NO3)x的水溶液,当阴极上增重a g时,在阳极上同时产生b L氧气(标准状况),从而可知M的相对原子质量为
A.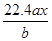 |
B.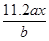 |
C.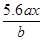 |
D.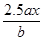 |