X、Y、Z、L、M五种元素的原子序数依次增大。X、Y、Z、L是组成蛋白质的基础元素,M是地壳中含量最高的金属元素。
回答下列问题:
⑴ L的元素符号为________;M在元素周期表中的位置为____________;
⑵ Z、X两元素按原子数目比2∶4构成分子则其结构式为____________。
⑶ 硒(se)是人体必需的微量元素,与L同一主族,Se原子比L原子多两个电子层,则其最高价氧化物对应的水化物化学式为_______。该族2 ~ 5周期元素单质分别与H2反应生成l mol气态氢化物的反应热如下:
a.+99.7 mol·L-1 b.+29.7 mol·L-1 c.-20.6 mol·L-1 d.-241.8 kJ·mol-1
其中表示生成1 mol硒化氢反应热的是__________(填字母代号)。
瑞典化学家舍勒在研究软锰矿(主要成分是MnO2)的过程中,将它与浓盐酸混合加热,产生了一种黄绿色、刺激性气味的气体——氯气。某学生使用这一原理设计如图所示的实验装置,并且利用制得的氯气探究其性质,据此回答下列问题: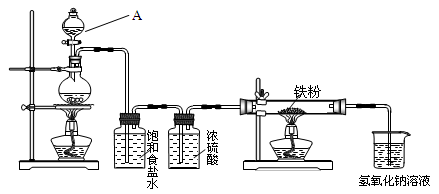
(1)A仪器的名称是 。
(2)上述制备氯气的化学反应方程式为_________________________________________,反应中浓盐酸被还原和未被还原的物质的量之比为_________。
(3)浓硫酸的作用是,烧杯中发生反应的离子方程式为
,作用是。
(4)为探究铁与氯气反应的产物,某小组同学提出如下设想:
①产物只有FeCl3;②产物只有FeCl2;③。
甲同学设计实验:取少量固体样品溶于足量水,滴加KSCN溶液,如果未出现血红色,再滴加氯水,出现血红色,得出结论为②是正确的;
乙同学设计实验:取少量固体样品溶于足量水,滴加KSCN溶液,如果出现血红色,则产物中必含FeCl3。
请问上述观点错误的是,原因是 。
(用化学方程式或离子方程式和文字说明)
实验室里迅速制备少量氯气可利用以下反应:
2 KMnO4+16 HCl(浓)="=" 2 KCl + 2 MnCl2 + 5 Cl2↑ + 8 H2O
此反应不需要加热,常温下就可以迅速进行。
①用“线桥法”表示出电子转移情况:
2 KMnO4+16 HCl(浓) ="==" 2 KCl + 2 MnCl2 + 5 Cl2↑ + 8 H2O
② 当电子转移的数目为6.02×1023个时生成的氯气的物质的量为 mol
(1)在Al2(SO4)3溶液中,逐滴滴加NaOH溶液直至过量过程中,观察到的现象是,请用化学方程式表示其现象:、。
(2)实验室里盛装NaOH溶液试剂瓶用橡皮塞或软木塞,而不用玻璃塞。用化学方程式解释:。
(3)写出Cu与浓HNO3反应的化学方程式:。
(4)透闪石为硅酸盐,化学式是Ca2Mg5Si8O22(OH)2,改写成氧化物形式为_________。
(15分)【 化学——选修3物质结构与性质】
有A、B、c、D、E五种原子序数依次增大的元素(原子序数均小于30)。A的基态原子2p能级有3个单电子;C的基态原子2p能级有1个单电子;E的原子各内层均排满,且最外层有成单电子;D与E同周期,价电子数为2。则:
(1)写出基态E原子的价电子排布式
(2)A的单质分子中 键的个数为
键的个数为
(3)A、B、c三元素第一电离能由大到小的顺序为(用元素符号表示)。
(4)B元素的氢化物的沸点是同族元素中最高的,原因是。
(5)A的最简单氢化物分子的空间构型为,其中A原子的杂化类型是。
(6)c和D形成的化合物的晶胞结构如图,已知晶体的密度为 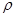 g/cm3,阿伏加德罗常数为NA,求晶胞边长a=cm。(用含队
g/cm3,阿伏加德罗常数为NA,求晶胞边长a=cm。(用含队 、NA的计算式表示)
、NA的计算式表示)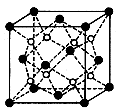
(15分) I.工业上用CO生产燃料甲醇。一定条件下发生反应:co(g)+2H2(g) CH3OH(g)。下图中甲图表示反应过程中能量的变化情况;乙图表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间的变化情况。
CH3OH(g)。下图中甲图表示反应过程中能量的变化情况;乙图表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间的变化情况。
请回答下列问题。
(1)下列说法正确的是(填字母序号)。
a.在甲图中,曲线b表示使用了催化剂
b.起始充入的CO为2mol,从反应开始到达到平衡,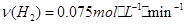
c.增大CO的浓度,CO的转化率增大
d.容器中压强恒定时,说明反应已达平衡状态
e.保持温度和密闭容器的容积不变,再充入1mol CO和2mol H2,再次达到平衡时 的值会变小
的值会变小
(2)该温度下CO(g)+2H2 (g)  CH3OH(g)的化学平衡常数为。若保持其他条件不变,将反应体系升温,则该反应的化学平衡常数(填“增大”“减小”或“不变”)。
CH3OH(g)的化学平衡常数为。若保持其他条件不变,将反应体系升温,则该反应的化学平衡常数(填“增大”“减小”或“不变”)。
(3)请在丙图所示坐标图中画出平衡时甲醇的百分含量(纵坐标)随温度(横坐标)的变化曲
线,要求画出压强不同的两条曲线(在曲线上标出P1、P2且P1<P2)。
(4)已知CH3OH(g)+3/2 O2(g)="===" C02(g)+2H2O(g) △H=-192.9kJ/mol,又知H20(1)=====H2O(g)
△H= +44kJ/mol,请写出32g CH3OH(g)完全燃烧生成CO2和液态水的热化学方程式
II.已知:在25℃时,H20 H++ OH — Kw=10-14;
H++ OH — Kw=10-14;
CH3COOH H++ CH3COO —Ka=1.8×10-5 。
H++ CH3COO —Ka=1.8×10-5 。
(5)醋酸钠水解的平衡常数Kh的表达式为
(6)0.5mol·L-1醋酸钠溶液的pH为m,其水解的程度(已水解的醋酸钠与原有醋酸钠的比值)为a;1mol·L-1醋酸钠溶液的pH为n,水解的程度为b。则a与b的关系为ab(填“大于”“小于”或“等于”)。
(7)0.9mol.L-1醋酸钠溶液中氢氧根离子的浓度为2.2×10-5mol·L-1 。在某溶液中含Mg2+、Cd2+ 、Zn2+ 三种离子的浓度均为0.01mol·L-1,向其中加入固体醋酸钠,使其浓度为0.9mol·L-1,则能生成的沉淀化学式为
已知:Ksp[ Mg(OH)2 ]=1.8×10-11、Ksp[ Zn(OH)2 ]=1.2×10-17 、Ksp [ Cd(OH)2 ]="2.5" x 10-14 。