向某溶液中加入BaCl2溶液,再加入稀硝酸,产生的白色沉淀不消失,下列叙述正确的是( )
| A.溶液中一定含有SO42﹣ |
| B.溶液中一定含有Ag+ |
| C.溶液中一定含有SO32﹣ |
| D.溶液中可能含有SO42﹣、SO32﹣、Ag+中的某一种、两种或三种 |
为鉴别K2CO3和NaHCO3两种白色固体,有五位同学为鉴别它们,分别设计了下列五种不同的方法,其中不可行的是()
①分别取样加入1mol/L的盐酸溶液,看有无气泡产生
②分别取样在试管中加热,将可能产生的气体通入澄清石灰水,观察有无白色浑浊
③分别取样配成溶液,滴加BaCl2溶液,观察有无白色浑浊
④分别配成溶液,用铂丝蘸取溶液在酒精灯火焰上灼烧,观察火焰的颜色
⑤分别取样配成溶液,滴加澄清石灰水,观察有无白色浑浊
| A.①③⑤ | B.②④ | C.①⑤ | D.③ |
关于3Cl2 + 6KOH 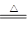 KClO3 + 5KCl + 3H2O反应,以下说法正确的是 ( )
KClO3 + 5KCl + 3H2O反应,以下说法正确的是 ( )
| A.Cl2是氧化剂,KOH是还原剂 |
| B.被氧化的氯元素的质量为被还原的氯元素质量的5倍 |
| C.3mol氯气参加反应转移10mol电子 |
| D.KOH既不是氧化剂,又不是还原剂 |
要配制100毫升1.00mol/L的NaOH溶液,下列操作正确的是:()
| A.将NaOH放在白纸上,用托盘天平准确称量4.0克 |
| B.烧杯中溶液转移到100毫升容量瓶中,未洗涤直接加蒸馏水至刻度线 |
| C.加蒸馏水定容,当液面离容量瓶的刻度线1-2cm时改用胶头滴管滴加至凹液面和刻度线相切 |
| D.如果不慎加水超过了刻度线,立即用胶头滴管吸取部分溶液,使液面和刻度线相平 |
下列化学实验事实及其解释都正确的是( )
| A.氯气可以使湿润的有色布条褪色,是因为氯气具有漂白性 |
| B.SO2溶于水,其水溶液能导电,说明SO2是电解质 |
| C.用饱和Na2CO3溶液可将BaSO4转化为BaCO3,说明BaCO3比BaSO4更难溶 |
| D.某溶液用盐酸酸化无明显现象再滴加硝酸钡溶液有白色沉淀产生,说明溶液中有SO42— |
下列事实与胶体性质无关的是()
| A.在豆浆里加入盐卤做豆腐 |
| B.在河流入海口易形成沙洲 |
| C.一束平行光线照射蛋白质溶液时,从侧面可以看到一条光亮的通路 |
| D.三氯化铁溶液中滴入氢氧化钠溶液出现红褐色沉淀 |