氰(CN)2、硫氰(SCN)2的化学性质和卤素很相似,化学上称为“类卤素”,它们阴离子的还原性强弱为:Cl﹣<Br﹣<CN﹣<SCN﹣<I﹣.
试写出:
(1)(CN)2与KOH(aq)反应的化学方程式: ;
(2)NaBr和KSCN的混合溶液中加入足量(CN)2反应的离子方程式: .
19.( 12分) 将物质的量均为3.00mol物质A、B混合于5L溶 器中,发生如下反应 3A+B 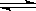 2C,在反应过程中C的物质的量分数随温度变化如图所示:
2C,在反应过程中C的物质的量分数随温度变化如图所示: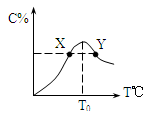
(1) T0对应的反应速率V正和V逆的关系是_____(用含“>”“<”“=”表示,下同);
(2) 此反应的正反应为______热反应;
(3) X、Y两点A物质正反应速率的大小关系是______________;
(4) 温度T<T0时,C%逐渐增大的原因是________________________;
(5) 若Y点的C的物质的量分数为25%,则参加反应的A的物质的量为_______;若Y点时所耗时间为2 min,则B物质的反应速率为__________。
18.(9分) 按要求写热化学方程式:
(1) 已知稀溶液中,1 mol H2SO4与NaOH溶液恰好完全反应时,放出114.6 kJ热量,写出表示H2SO4与NaOH反应的中和热的热化学方程式
___________________________________________________________________。
(2) 25℃、101 kPa条件下充分燃烧一定量的丁烷气体放出热量为Q kJ,经测定,将生成的CO2通入足量澄清石灰水中产生25 g白色沉淀,写出表示丁烷燃烧热的热化学方程式________________________________________________________。
(3) 已知下列热化学方程式:
①CH3COOH(l)+2O2(g)===2CO2(g)+2H2O(l)ΔH1=-870.3 kJ/mol
②C(s)+O2(g)===CO2(g)ΔH2=-393.5 kJ/mol
③H2(g)+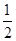 O2(g)===H2O(l)ΔH3=-285.8 kJ/mol
O2(g)===H2O(l)ΔH3=-285.8 kJ/mol
写出由C(s)、H2(g)和O2(g)化合生成CH3COOH(l)的热化学方程式______________________________________.
17.(10分) 科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池。已知H2(g)、CO(g)和CH3OH(l )的燃烧热 分别为-285.8 kJ·mol-1 、-283.0 kJ·mol-1和-726.5 kJ·mol-1。请回答下列问题:
分别为-285.8 kJ·mol-1 、-283.0 kJ·mol-1和-726.5 kJ·mol-1。请回答下列问题:
(1) 用太阳能分解10 mol水消耗的能量是kJ;
(2) 甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为;
(3) 在容积为2 L的密闭容器中,由CO2和H2合成甲醇,在其他条件不变的情况下,考察温度对反应的影响,实验结果如下图所示(注:T1、T2均大于300℃):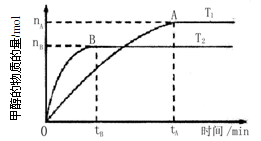
下列说法正确的是(填序号)
①温度为T1时,从反应开始到平衡,生成甲醇的平均速率为v(CH3OH)=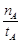 mol·L-1·min-1
mol·L-1·min-1
②该反应在T1时的平衡常数比T2时的小
③该反应为放热反应
④处于A点的反应体系从T1变到T2,达到平衡时 增大
增大
(4) 在T1温度时,将1 mol CO2和3 mol H2充入一密闭恒容容器中,充分反应达到平衡后,若CO2的转化率为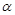 ,则容器内的压强与起始压强之比为.
,则容器内的压强与起始压强之比为.
16.下列反应在210℃时达到平衡:
①PCl5(g) PCl3(g)+Cl2(g); △H1>0 K1=1mol·L—1
PCl3(g)+Cl2(g); △H1>0 K1=1mol·L—1
②CO(g)+Cl2(g) COCl2(g);△H1<0 K2=5×104L·mol—1
COCl2(g);△H1<0 K2=5×104L·mol—1
③COCl2(g) CO(g)+Cl2(g)
CO(g)+Cl2(g)
(1)反应③的平衡常数K3 =。
(2)要使反应①和反应②的K数值相等,可采取的措施是(填序号)。
| A.降低反应①、②体系中Cl2浓度 |
| B.反应①、②选择不同的催化剂 |
| C.反应①、反应②同时升高温度 |
| D.反应①、反应②同时降低温度 |
E.反应①降低温度,反应②维持210℃
15、(4分) 一定温度下,A、B两瓶乙酸的浓度分别是1 mol/L和0.1 mol/L,则A、B两瓶乙酸溶液中[ H+ ]之比10(填 “<”、“>”或“=”),并简述理由。