铁及其化合物在日常生活、生产中应用广泛.研究铁及其化合物的应用意义重大.
I.水体的净化和污水的处理与铁及其化合物密切相关.
(1)自来水厂常用高铁酸钠(Na2FeO4)改善水质.简述高铁酸钠用于杀菌消毒同时又起到净水作用的原理 .
(2)碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂,在医药上也可用于治疗消化性溃疡出血.工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下:
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Al(OH)3 |
| 开始沉淀 |
2.3 |
7.5 |
3.4 |
| 完全沉淀 |
3.2 |
9.7 |
4.4 |
回答下列问题:
①写出反应I中主要发生的氧化还原反应的离子方程式 .
②加入少量NaHCO3的目的是调节溶液pH,应控制pH的范围为 .
③在实际生产中,反应II常同时通入O2以减少NaNO2的用量,若通入5.6L O2(标准状况),则相当于节约NaNO2的质量为 g.
④碱式硫酸铁溶于水后产生的[Fe(OH)]2+离子,可部分水解生成[Fe2(OH)4]2+聚合离子.该水解反应的离子方程式为 .
II铁的化合物也是制备高能锂电池的重要原料.已知磷酸亚铁锂电池总反应为:FePO4+Li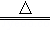 LiFePO4,电池中的固体电解质可传导Li+.试写出该电池充电时的阳极反应式 .
LiFePO4,电池中的固体电解质可传导Li+.试写出该电池充电时的阳极反应式 .
30、从H+、Cu2+、Na+、Ag+ 、NO3-、SO42-、Cl- 七种离子中恰当地组成电解质,按下列要求进行电解:
(1)以碳棒为电极,使电解质质量减少,水质量不变,进行电解,则可采用的电解质是
。
(2)以碳棒为电极,使电解质质量不变,水质量减少,进行电解,则可采用的电解质是
。
(3)以碳棒为阳极,铁棒为阴极,使电解质和水质量都减少,电解后生成碱和氢气,则电解质为。
(4)以碳棒为阳极,铁棒为阴极,使电解质和水质量都减少,电解后生成酸和氧气,,则电解质为。
某课外小组利用H2还原CuO粉末测定铜元素的相对原子质量,下图是测定装置的示意图,A中的试剂是盐酸,C中试剂是稀氢氧化钠溶液。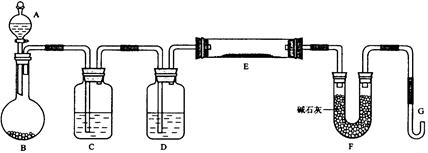
请回答下列问题。
(1)仪器中装入的试剂:B、D。
(2)装置C的作用是。
(3)连接好装置后应首先。
(4)“①加热反应管E”和“②从A瓶逐滴滴加液体”这两步操作应该先进行的是(填序号)。在这两步之间还应进行的操作是。
(5)反应过程中G管逸出的气体是,其处理方法是。
(6)从实验中测得了下列数据:
①空E管的质量a;②E管和CuO的总质量b;
③反应后E管和Cu粉的总质量c(冷却到室温称量);
④反应前F管及内盛物的总质量d;⑤反应后F管及内盛物的总质量e。
由以上数据可以列出计算Cu的相对原子质量的两个不同计算式(除Cu外,其他涉及的元素的相对原子质量均为已知):
计算式1:Ar(Cu)=;计算式2:Ar(Cu )=。
海带中含有丰富的碘。为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:
(1)①~⑥中发生化学变化的有。
(2)步骤③的实验操作名称是;步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,该步骤的实验操作名称是。
(3)步骤⑤中所使用玻璃仪器的名称是。该小组选择用苯来提取碘的理由是。
(1)除去KCl溶液中的K2SO4,依次加入的试剂是(填化学式),按实验操作顺序发生的第一个反应的化学方程式为。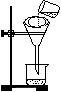
(2)除去NaNO3固体中混有的少量KNO3,所进行的实验操作依次为:
 |
回答下列问题:
①操作A所需的仪器有;
②操作B的名称是;
③过滤步骤的装置和操作如图所示,指出图中的两处错误:
;
。
天然碱是一种重要的矿物质,盛产于我国的青海湖地区。某天然碱样品的成分可以看成是碳酸钠、碳酸氢钠和水按物质的量之比1:1:2形成的结晶水合物。请回答下列问题:
(1)这种天然碱中碳酸钠、碳酸氢钠和水三者的质量比为。
(2)45.2 g此天然碱与100 mL密度为1.1 g/cm3的中等浓度盐酸恰好完全反应,产生a mol CO2,则a=,盐酸中溶质的质量分数ω(HCl)=%。
(3)用一个化学方程式表示该天然碱与盐酸的反应:
。