从辉铜矿(Cu2S)中利用火法炼铜可以提取铜,发生如下反应: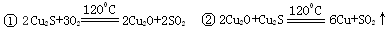
下面是由Cu2S冶炼铜及制取CuSO4·5H2O的流程图:
⑴Cu2S中铜元素的化合价为 ,当有1molCu2S与O2反应生成2molCu时,转移电子的物质的量是 。
⑵Cu2O、CuO中加入足量稀硫酸得到的体系A中看到溶液呈蓝色,且有红色物质生成,请写出生成红色物质的离子方程式 。
⑶若使A中单质溶解,操作Ⅰ中加入的试剂最好是 。(选填字母代号)
A.适量的HNO3 B.适量的NaOH C.适量的H2O2
该反应的离子方程式为 。
⑷取5.00 g胆矾样品逐渐升高温度使其分解,分解过程的热重曲线(样品质量随温度变化的曲线)如下图所示:
①由图中可以看出,胆矾分解的最低温度是 。
②通过计算确定258℃时发生反应的化学方程式为 ,e点对应的化学式为 (计算过程略去)。
某溶液中含有Al3+,Cu2+,Ag+,现用NaOH溶液、盐酸和试剂X将这三种离子逐一沉淀分离。其流程图如图: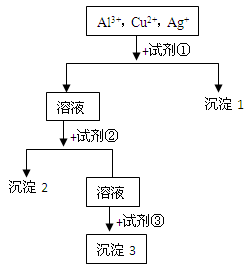
(1)试剂X要过量,其化学式为,是图中的试剂(选填①、②或③)。
(2)沉淀的化学式:沉淀1,沉淀2,沉淀3。
(3)写出混合液+试剂①的离子方程式;
溶液+试剂②的离子方程式
,。
请你按要求填写下表,以除去下列物质中所混有的少量杂质。
| 混合物 |
实验方案 |
反应化学方程式 |
(1)铁粉中 混有少量铝粉 混有少量铝粉 |
||
| (2)Na2CO3固体中混有少量NaHCO3 |
||
(3)FeCl3溶液 中混有少量FeCl2 中混有少量FeCl2 |
现有常见金属单质A、B、C和常见气体甲、乙、丙及物质D、E、F、G、H,它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。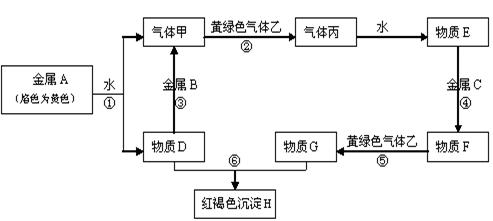
请根据以上信息回答下列问题:
⑴.写出下列物质的化学式:
A BF 丙
⑵.写出下列反应离子方程式:
| 座号 |
反应③
反应⑤
反应⑥
下表是元素周期表的一部分,回答下列有关问题: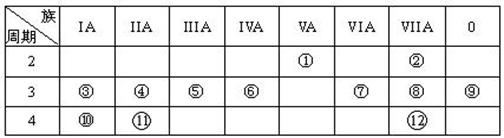
⑴.写出下列元素符号:① ⑥ ⑦
⑵.在①~⑫元素中,金属性最强的元素是,非金属性最强的元素是,最不活泼的元素是。(均填元素符号)
⑶.元素⑦与元素⑧相比,非金属性较强的是 (用元素符号表示),下列表述中能证明这一事实的是 。
a.常温下⑦的单质和⑧的单质状态不同 b.⑧的氢化物比⑦的氢化物稳定
c.一定条件下⑦和⑧的单质都能与氢氧化钠溶液反应
⑷.第三周期中原子半径最大的元素是 (填序号),跟它同周期原子半径最小的元素是 (填序号),它们可以形成 (填离子或共价)化合物。
已知A、B、C、D分别是AlCl3、BaCl2、FeSO4、NaOH四种化合物中的一种,它们的水溶液之间的一些反应现象如下:
①A+B→白色沉淀,加入稀硝酸,沉淀不溶解。
②B+D→白色沉淀,在空气中放置,沉淀由白色转化为红褐色。
③C+D→白色沉淀,继续加D溶液,白色沉淀逐渐消失。
⑴.四种物质的化学式为:A、B、C、D。
⑵.现象③中所发生反应的离子方程式为:
、。