将CO2气体缓缓地通入到含KOH、Ba(OH)2和KAlO2的混合溶液中直至过量,生成沉淀的物质的量与所通CO2的体积关系如图所示。下列关于整个反应进程中的各种描述不正确的是( )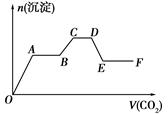
| A.O~A段反应的化学方程式是Ba(OH)2+CO2=BaCO3↓+H2O |
| B.B~C段反应的离子方程式是2AlO2-+3H2O+CO2=2Al(OH)3↓+CO32- |
| C.A~B段与C~D段所发生的反应相同 |
| D.D~E段沉淀的减少是由于碳酸钡固体的消失所致 |
下列晶体中,熔点最高的是()
| A.KF | B.MgO | C.CaO | D.NaCl |
下列微粒中,未成对电子数最多的是()
| A.O | B.P | C.Fe | D.Fe3+ |
若将P原子的电子排布式写成1s22s22p63s23px23py1,它违背了()
| A.能量守恒原理 | B.泡利不相容原理 | C.能量最低原理 | D.洪特规则 |
A、B、C、D、E是同一周期的五种主族元素,A和B的最高价氧化物对应的水化物均呈碱性,且碱性B>A,C和D的电负性C>D;E是这五种元素中原子半径最小的元素,则它们的原子序数由小到大的顺序是()
A.A、B、C、D、E B.E、C、D、B、A
C.B、A、D、C、E D.C、D、A、B、E
下列化合物中,既有离子键,又有共价键的是()
| A.Na2O2 | B.NH3 | C.CaCl2 | D.HCl |