将几滴KSCN(SCN-是“类卤离子”)溶液加入到含有Fe3+的酸性溶液中,溶液变成红色。将该红色溶液分为两份:①一份中加入适量KMnO4溶液,红色褪去;②向另一份中通入SO2,红色也褪去。以下推测肯定不正确的是( )
| A.①中红色褪去的原因是KMnO4将SCN-氧化 |
| B.②中红色褪去的原因是SO2将Fe3+还原成Fe2+ |
| C.②中红色褪去的原因是SO2将SCN-还原 |
| D.SCN-在适当条件下可失去电子被氧化为(SCN)2 |
下列说法中不正确的是
| A.液氨、液态氯化氢都是电解质 |
| B.Na2O2、HClO、SO2等物质都具有漂白作用 |
| C.置换反应都是氧化还原反应,复分解反应都是非氧化还原反应 |
| D.明矾能水解生成氢氧化铝胶体,可用作净水剂 |
向100mL pH=0的硫酸和硝酸混合溶液中投入3.84g铜粉,微热使反应充分完成后,生成NO气体448mL(标准状况)。则反应前的混合溶液中含硝酸的物质的量为
| A.0.02mol | B.0.08mol | C.0.10mol | D.0.16mol |
在温度相同,压强分别为P1和P2的条件下,A(g)+2B(g)  nC(g)的反应体系中,C的百分含量(c%)与时间t的曲线如图所示,下面结论正确的是
nC(g)的反应体系中,C的百分含量(c%)与时间t的曲线如图所示,下面结论正确的是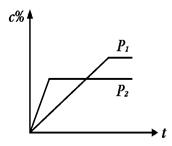
| A.P1>P2,n<3 | B.P1<P2,n>3 |
| C.P1>P2,n>3 | D.P1<P2,n<3 |
Na2CO3水溶液中存在CO2-3+H2O HCO-3+OH-平衡。下列说法不正确的是
HCO-3+OH-平衡。下列说法不正确的是
A.稀释溶液,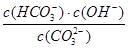 增大 增大 |
| B.通入CO2,溶液pH减小 |
| C.升高温度,此平衡常数增大 |
D.加入NaOH固体,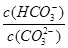 减小 减小 |
常温下,下列各组离子在指定溶液中能大量共存的是
| A.pH=1的溶液中:Fe2+、NO3-、SO42-、Na+ |
| B.由水电离的c(H+)=1×10-14 mol·L-1的溶液中:Ca2+、K+、Cl-、HCO3- |
| C.c(H+)/c(OH-)=1012的溶液中:NH4+、Al3+、NO3-、Cl- |
| D.c(Fe3+)="0.1" mol·L-1的溶液中:K+、ClO-、SO42-、SCN- |