以下有关物质的质量分数和物质的量浓度的叙述正确的是
| A.等体积硫酸铁、硫酸铜、硫酸钾溶液分别与足量的氯化钡溶液反应,若生成硫酸钡沉淀的质量相等,则三种硫酸盐溶液的物质的量浓度之比为1:1:1 |
| B.Na2O2和Na2O各0.1mol分别放入100g水中,所得溶液的物质的量浓度不相等 |
| C.质量分数分别为5%和15%的氨水等体积混合后所得溶液的质量分数为10% |
D.20℃时,饱和KCl溶液的密度为1.174g•cm-3,物质的量浓度为4.0 mol•L-1,则此溶液中KCl的质量分数为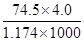 ×100% ×100% |
下列物质的化学式可以表示真实的分子的是( )
| A.K2S | B.CO2 | C.NaOH | D.SiO2 |
下列化学用语正确的是()
A.氮分子的电子式: |
B.硫原子的结构示意图: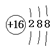 |
C.溴化钠的电子式: |
D.水分子的结构式: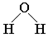 |
下列变化中,吸收的热量用于克服分子间作用力的是()
| A.加热氯化钠晶体使之熔化 | B.液氨受热蒸发 |
| C.加热碘化氢气体使之分解 | D.加热硅晶体使之熔化 |
下列各组物质的晶体中,化学键类型相同,晶体类型也相同的是()
| A.干冰和二氧化硅 | B.食盐和金刚石 | C.烧碱和冰 | D.碘片和足球烯 |
下列性质可以证明NaCl是离子化合物的是()
| A.可溶于水 | B.具有较高的熔点 | C.水溶液能导电 | D.熔融状态下能导电 |