用下图装置进行实验。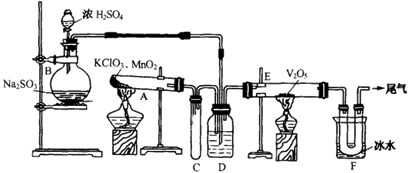
回答有关问题:
(1)玻璃管E内发生反应的化学方程式是 。
(2)小试管C的作用是 。
(3)广口瓶D内盛的试剂是 ,装置D的3个作用是① , ② , ③ 。
(4)从管E导出的气体成分是 。
(5)装置F中U形管观察到所收集物质的颜色状态是 。
(6)若U形管内收集到的物质很少,分析其原因不可能是 (填标号)。
a.装置气密性不好; b.制得的SO2中混有少量H2S杂质使催化剂中毒;c.气流速度过快。
(7)从U形管导出的尾气的处理方法是 。
(15分)电石的主要成分为CaC2,易与水反应生成C2H2,故C2H2俗称电石气。某同学设计如下方案测定电石中CaC2的纯度(杂质不参加反应)。
实验原理:CaC2+2H2O=Ca(OH)2+C2H2↑
通过测定生成的气体的体积(标准状况),可确定样品中CaC2的含量。
实验步骤:
①取样品1.2g;
②把1.2 g样品放入气密性良好的气体发生装置,如图所示;
③向样品中滴入水,至不再产生气泡,用量筒排水集气,量筒内液面在360mL处恰与水槽内液面相平
④作为反应器的烧瓶中有24 mL液体。
请回答下列问题:
(1)上述实验所用的玻璃仪器有导管、水槽、、、。
(2)若实验前有1000 mL、500 mL、250 mL的量筒备用,则应选用mL的量筒。
(3)生成气体体积是mL,为保证生成气体体积的准确性,读取量筒刻度时应注意的问题是。
(4)若将C2H2通入KMnO4溶液中,KMnO4溶液的紫红色会变浅,配平并完成化学方程式
若该实验生成的C2H2完全被KMnO4溶液氧化,至少需0.1 mol • L-1的KMnO4溶液mL。
(5)通过以上数据计算,可得样品中CaC2的纯度为。
对叔丁基苯酚 工业用途广泛,可用于生产油溶性酚醛树脂、稳定剂和香料等。实验室以苯酚、叔丁基氯[(CH3)3CCl]等为原料制备对叔丁基苯酚。实验步骤如下:反应物和产物的相关数据列表如下:
工业用途广泛,可用于生产油溶性酚醛树脂、稳定剂和香料等。实验室以苯酚、叔丁基氯[(CH3)3CCl]等为原料制备对叔丁基苯酚。实验步骤如下:反应物和产物的相关数据列表如下:
步骤l:组装仪器,用量筒量取2.2 mL叔丁基氯(过量),称取1.6 g苯酚,搅拌使苯酚完全溶解,并装入滴液漏斗。
步骤2:向X中加入少量无水AlCl3固体作催化剂,打开滴液漏斗旋塞,迅速有气体放出。
步骤3:反应缓和后,向X中加入8 mL水和1 mL浓盐酸,即有白色固体析出。
步骤4:抽滤得到白色固体,洗涤,得到粗产物,用石油醚重结晶,得对叔丁基苯酚1.8 g。
(1)仪器X的名称为。
(2)步骤2中发生主要反应的化学方程式为。该反应过于激烈,放出大量热,常使实验的产率降低,可能的原因是。
(3)图中倒扣漏斗的作用是。苯酚有腐蚀性,能使蛋白质变性,若其溶液沾到皮肤上可用洗涤。
(4)在取用苯酚时发现苯酚冻结在试剂瓶中,可采取的措施为____。
(5)下列仪器在使用前必须检查是否漏液的是(填选项字母)。
| A.量筒 |
| B.容量瓶 |
| C.滴定管 |
| D.分液漏斗 |
E.长颈漏斗
(6)本实验中,对叔丁基苯酚的产率为。(请保留三位有效数字)
用下图所示实验装置进行相应实验,能达到实验目的的是
| A.制氨气时,用装置①吸收尾气 |
| B.按装置②所示的气流方向收集NH3等 |
| C.用图③所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体 |
| D.用图④所示装置分离CCl4萃取碘水后的混合液 |
某校化学研究性学习小组查阅资料了解到以下内容:
乙二酸(HOOC-COOH,可简写为H2C2O4)俗称草酸,易溶于水,属于二元中强酸(为弱电解质),且酸性强于碳酸,草酸在常温下呈无色晶体状,其晶体的熔化温度低于草酸的分解温度,且易升华。为探究草酸的部分化学性质,进行了如下实验:
(1)向盛有1 mL饱和NaHCO3溶液的试管中加入足量乙二酸溶液,观察到有无色气泡产生。该反应的离子方程式为____________________________________。
(2)取一定量草酸溶液装入试管,加入一定体积的酸性高锰酸钾溶液,振荡试管,发现溶液开始缓慢褪色,后来迅速变成无色。(反应热效应不明显,可忽略不计)
①该实验说明草酸具有________(填“氧化”或“还原”)性,该反应的反应速率先慢后快的主要原因可能是_______ _______。
②请配平该反应的离子方程式:______MnO4-+____H2C2O4+____ ===____Mn2++____CO2↑+____。
(3)为了探究草酸的不稳定性,某同学设计了如下实验装置:
①C、H装置均变浑浊,E处无现象,G玻璃管里黑色变红色,写出A中反应的化学方程式:。
②上述装置中,B装置的作用是。 D的作用是。从环境保护角度来看,该方案的不足之处是。
(4)该小组同学将2.52 g草酸晶体(H2C2O4·2H2O)加入到100 mL 0.2 mol·L-1的NaOH溶液中充分反应,测得反应后溶液呈酸性,形成的溶液中各离子的浓度由大到小的顺序为_______________(用离子符号表示)。
果汁在生产过程中添加亚硫酸及其盐类,以抑制有害微生物的生长及抗氧化。某化学兴趣小组查阅文献后,用下图所示装置测定某果汁样品中SO2残留量。
实验步骤:
(ⅰ)在烧瓶中加入50.00 mL果汁样品与3mL浓硫酸的混合液,加热10 min。
(ⅱ)移出锥形瓶,迅速滴入2~3滴酚酞试液,用0.01000mol·L-1NaOH标准溶液滴定。
回答问题:
(1)实验室配制NaOH标准溶液时,不需要用到的仪器是。
A.容量瓶 B.胶头滴管 C.烧瓶 D.玻璃棒
(2)将50. 00 mL果汁样品与3mL浓硫酸混合的操作是。
(3)锥形瓶中发生反应的离子方程式是。
(4)若步骤(ⅱ)消耗NaOH标准溶液25. 00 mL,则果汁样品中SO2残留量是g/L。
(5)若改用0.5%的碘水10 mL作吸收液,实验中消耗NaOH标准溶液体积。
A.V =" 25" mLB.25 mL<V<50 mLC.V>50 mL