下列反应的离子方程式表示正确的是
| A.澄清石灰水中通入过量二氧化碳:OH-+CO2 =HCO3- |
| B.铜片跟三氯化铁溶液反应:Fe3++Cu =Cu2++Fe2+ |
| C.漂白粉溶液中通入少量SO2:Ca2++2ClO-+SO2+H2O =CaSO3↓+2HClO |
| D.Fe3O4与稀HNO3反应:Fe3O4+8H+ =Fe2++2Fe3++4H2O |
从淡化海水中提取溴的流程如下:
下列有关说法不正确的是( )
| A.X试剂可用Na2SO3饱和溶液 |
| B.步骤Ⅲ的离子反应:2Br-+Cl2=2Cl-+Br2 |
| C.工业上每获得1molBr2,需要消耗Cl244.8L |
| D.步骤Ⅳ包含萃取、分液和蒸馏 |
下图是某煤发电厂处理废气的装置示意图。下列说法错误的是( )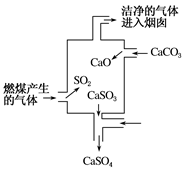
| A.使用此废气处理装置可减少酸雨的形成 |
| B.装置内发生的反应有化合、分解、置换和氧化还原反应 |
| C.整个过程的反应可表示为2SO2+2CaCO3+O2=2CaSO4+2CO2 |
| D.可用酸性高锰酸钾溶液检验废气处理是否达标 |
溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32−、SO42−、NO3−中的几种。①加入铝片,产生无色无味的气体;②加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如下图所示。则下列说法正确的是( )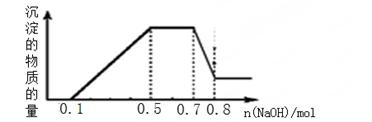
| A.溶液中一定不含CO32−,可能含有SO42−和NO3− |
| B.在滴加NaOH溶液物质的量为0.5至0.7mol时,发生的离子反应为:Al3++4OH-=[Al(OH)4]- |
| C.溶液中的阳离子只有H+、Mg2+、Al3+ |
| D.n(H+)∶n(NH4+)∶n(Mg2+) =2∶4∶1 |
分子式为C5H12O的醇与和它相对分子质量相等的一元羧酸进行酯化反应,生成的酯共有(不考虑立体异构)()
| A.15种 | B.16种 | C.17种 | D.18种 |
某工厂生产的某产品只含C、H、O三种元素,其分子模型如图所示(图中球与球之间的连线代表化学键,如单键、双键等)。下列对该产品的描述不正确的是() 
A. 官能团为碳碳双键、羧基
B. 与CH2=CHCOOCH3互为同分异构体
C. 能发生氧化反应
D. 分子中所有原子可能在同一平面