硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量,并检验该补血剂是否变质。实验步骤如下:
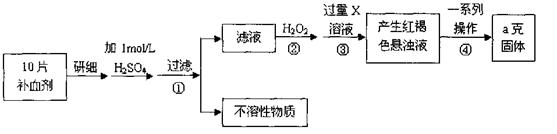
请回答下列问题:
(1)步骤①滤液中滴加KSCN溶液后滤液变为红色,则该溶液中含有 (填离子符号),检验滤液中还存在Fe2+的方法为
(注明试剂、现象)。
(2)步骤②加入过量H2O2的目的是 。
(3)步骤③中反应的离子方程式为 。
(4)步骤④中一系列处理的操作步骤包括:过滤、 、灼烧、 、称量。
(5)若实验无损耗,则每片补血剂含铁元素的质量为 g。
在花瓶中加入“鲜花保鲜剂”,能延长鲜花的寿命。下表是1L“鲜花保鲜剂”中含有的成分,阅读后回答下列 问题:
问题:
| 成分 |
质量(g) |
摩尔质量(g ·mol-1) |
| 蔗糖 |
51.3 |
342 |
| 硫酸钾 |
0.50 |
174 |
| 阿司匹林 |
0.35 |
180 |
| 高锰酸钾 |
0.50 |
158 |
| 硝酸银 |
0.04 |
170 |
⑴“鲜花保鲜剂”中蔗糖的物质的量浓度为___________________。
⑵在用托盘天平称量蔗糖时,若将蔗糖放在了右盘,50g砝码放在了左盘,调节游码1.3g,则实际称量所得蔗糖质量为___________。
⑶配制该1L“鲜花保鲜剂”所需的玻璃仪器除了烧杯、玻璃棒、量筒外还有______________________________。(在横线上填写所缺仪器的名称)
⑷在配制溶液时,玻璃棒有两种不同的用途,分别是____________、___________。
某课外活动小组设计了以下实验方案验证Ag与浓HNO3反应的过程中可能产生 NO。其实验流程图如下:
NO。其实验流程图如下:
⑴测定硝酸的物质的量
反应结束后,从如图B装置中所得100 mL溶液中取出25.00 mL溶液,用0.1 mol·L-1的NaOH溶液滴定,用酚酞作指示剂,滴定前后的滴定管中液面的位置如上图所示。在B容器中生成硝酸的物质的量为____________,则Ag与浓硝酸反应过程中生成的NO2的物质的量为______________。
⑵测定NO的体积
①从上图所示的装置中,你认为应选用________装置进行Ag与浓硝酸反应实验,选用的理由是____________________________________________________________
________________________________________________________________________。
②选用上图所示仪器组合一套可用来测定生成NO体积的装置,其合理的连接顺序是_________________________(填各导管口编号)。
③在测定NO的体积时,若量筒中水的液面比集气瓶的液面要低,此时应将量筒的位置______(选填“下降”或“升高”),以保证量筒中的液面与集气瓶中的液面持平。
⑶气体成分分析
若实验测得NO的体积为112.0 mL(已折算到标准状况),则Ag与浓硝酸反应的过程中________(填“有”或“没有”)NO产生,作此判断的依据是__________________
________________________________________________________________________。
小明通过学习知道:Na2CO3、NaHCO3均能与盐酸反应,Na2CO3溶液还会与石灰水反应。
[产生疑问]NaHCO3溶液也能与石灰水反应吗?如果能反应,生成物可能是什么?
[进行试验]小明将NaHCO3溶液与石灰水混合,结果产生白色沉淀,已知Ca(HCO3)2能溶于水,碳酸氢盐在碱溶液中会生成碳酸盐。此白色沉淀是;为了进一步了解生成的含钠化合物有什么,继续探究:
[作出猜想]①只有NaOH②有Na2CO3和NaOH③
[实验设计】步骤1:取少量上述实验后的上层清夜于试管中,再滴加足量的CaCl2溶液(中 性),观察到产生白色沉淀,由此可知生成的含钠化合物一定含有;
性),观察到产生白色沉淀,由此可知生成的含钠化合物一定含有;
步 骤2:将步骤1中反应后的混合物过滤,往滤液中先滴加几滴酚酞溶液,再滴加足量的稀盐酸,观察到溶液颜色变化情况为,整个实验过程中无气泡产生,由此可知猜想②成立。
骤2:将步骤1中反应后的混合物过滤,往滤液中先滴加几滴酚酞溶液,再滴加足量的稀盐酸,观察到溶液颜色变化情况为,整个实验过程中无气泡产生,由此可知猜想②成立。
[拓展提高]若步骤1中未出现白色沉淀,则此时NaHCO3溶液与Ca(OH)2溶液反应的化学方程式为。
请利用下列装置及试剂组装一套装置。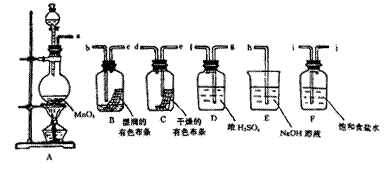
其流程是,先制取纯净干燥的Cl2 (不收集),后试验干燥的Cl2和潮湿的Cl2有无漂白性。
(不收集),后试验干燥的Cl2和潮湿的Cl2有无漂白性。
(1)按气体从左向右流向将各装置依次连接起来(填字母序号):
a接 ____ _ _____接h 。
(2)烧瓶中发生反应的化学方程式是。
(3)E装置的作用是,F装置的作用是。
(4)C瓶中的现象是,B瓶中的现象是。以上事实说明起漂白作用的物质是。
食盐是日常生活的必需品,也是重要的化工原料。
(1)粗食盐常含少量K+、Ca2+、Mg2+、Fe3+、SO42—等杂质离子,实验室提纯NaCl的流程如下: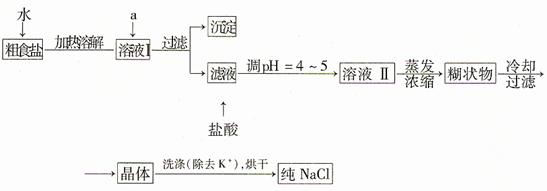
提供的试剂:饱和Na2CO3溶液、饱和K2CO3溶液、NaOH溶液、BaCl2溶液、Ba(NO3)2溶液 、 75%乙醇、四氯化碳;欲除去溶液I中的Ca2+、Mg2+、Fe3+、SO42—离子,选出a所代表的试剂,按滴加顺序依次是(只填化学式)。
(2)用提纯的NaCl配制500 mL 4.00 mol·L-1 NaCl溶液,所用仪器除药匙、玻璃棒、托盘天平、烧杯还需要(填仪器名称);若定容时仰视刻度线,则所配溶液的浓度(填“偏大”、“偏小”或“无影响”)。
(3)在电解饱和食盐水的实验中,若收集的H2为3.36 L(在标准状况下),则转移电子的个数为,同样条件下收集的Cl2(填“>”、“=”或“<”)3.36 L。
(4)实验室制备Cl2通常采用二氧化锰与浓盐酸共热来制取,发生反应的离子方程式为:;
据此,从下列所给仪器装置中选择制备并收集干燥、纯净Cl2的装置(填代号)
可选用制备气体的装置:
所选装置中的两个洗气瓶里应依次盛装、(填试剂的名称),请结合化学平衡移动原理解释第一个洗气瓶中试剂选择的理由;尾气用溶液(填化学式)吸收,写出发生反应的离子方程式。