科学家最近在-100℃的低温下合成了一种结构简式为 的烃X,经红外光谱和核磁共振表明其分子中的氢原子的化学环境没有区别,绘制了如图所示的球棍模型。下列说法中错误的是 ( )
的烃X,经红外光谱和核磁共振表明其分子中的氢原子的化学环境没有区别,绘制了如图所示的球棍模型。下列说法中错误的是 ( )
| A.烃X的分子式为C5H4 |
| B.分子中碳原子的化学环境有两种 |
| C.1molX在一定条件下可与2mol氢气发生反应 |
| D.X不能使酸性高锰酸钾溶液褪色 |
X、Y为两种元素的原子,X的阴离子与Y的阳离子具有相同的电子层结构,下列判断错误的是
| A.X的原子序数小于Y原子序数 |
| B.X的原子半径大于Y的原子半径 |
| C.X的氧化性大于Y的氧化性 |
| D.X的离子半径小于Y的离子半径 |
下列曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数, Y为元素的有关性质)。下列有关说法错误的是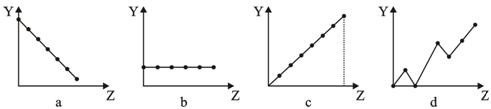
| A.a图表示第三周期元素的原子半径(稀有气体除外) |
| B.b图表示ⅡA族元素的最外层电子数 |
| C.c图表示第三周期元素的最高化合价 |
| D.d图表示第三周期元素单质的熔沸点 |
根据中学化学教材所附元素周期表判断,下列叙述不正确的是
| A.K层电子为奇数的所有元素所在族的序数与该元素原子的K层电子数相等 |
| B.L层电子为奇数的所有元素所在族的序数与该元素原子的L层电子数相等 |
| C.L层电子为偶数的所有短周期元素所在族的序数与该元素原子的L层电子数相等 |
| D.M层电子为奇数的所有主族元素所在族的序数与该元素原子的M层电子数相等 |
最新研究表明生命起源于火山爆发,是因为火山爆发产生的气体中含有1%的羰基硫(COS),已知羰基硫分子中所有原子的最外层都满足8电子结构,结合已学知识,判断有关说法不正确的是
| A.羰基硫属于极性分子 |
B.羰基硫的电子式为: |
| C.羰基硫沸点比CO2低 |
| D.羰基硫分子中三个原子处于同一直线上 |
第3周期元素的原子,其最外层3p亚层上有一个未成对电子,它的最高价氧化物对应水化物的酸根离子可能是
| A.RO5- | B.RO3- | C.RO42- | D.RO4- |