在下列溶液中,能大量共存的一组离子是( )
| A.pH=1的溶液中:NH4+、Fe2+、SO42-、Cl- |
| B.通入过量SO2气体的溶液中:Fe3+、NO3-、Ba2+、H+ |
| C.c(Al3+)=0.1 mol/L的溶液中:Na+、K+、AlO2-、SO42- |
| D.由水电离出的c(H+)=1×10-13 mol/L的溶液中:Na+、HCO3-、Cl-、Br- |
某温度下,在一个2L的密闭容器中,加入4molA和2molB进行如下反应:
3A(g)+2B(g) 4C(?)+2D(?),反应一段时间后达到平衡,测得生成1.6molC,且反应的前后压强之比为5:4(相同的温度下测量),则下列说法正确的是
4C(?)+2D(?),反应一段时间后达到平衡,测得生成1.6molC,且反应的前后压强之比为5:4(相同的温度下测量),则下列说法正确的是
A.该反应的化学平衡常数表达式是K=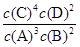 |
| B.此时,B的平衡转化率是35% |
| C.增大该体系的压强,平衡向右移动,化学平衡常数增大 |
| D.增加一定物质的量的C,B的平衡转化率不变 |
为减小CO2对环境的影响,在倡导“低碳”的同时,还需加强对CO2创新利用的研究。在T10C 时,将9molCO2和12molH2充入3L密闭容器中,发生反应CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH<0,容器中CH3OH的物质的量随时间变化如右图曲线I所示,平衡时容器内压强为P。改变某一条件重新进行上述反应,CH3OH的物质的量随时间变化如右图曲线II所示。下列说法正确的是
CH3OH(g)+H2O(g) ΔH<0,容器中CH3OH的物质的量随时间变化如右图曲线I所示,平衡时容器内压强为P。改变某一条件重新进行上述反应,CH3OH的物质的量随时间变化如右图曲线II所示。下列说法正确的是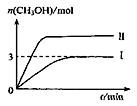
| A.曲线II对应的条件改变是减小压强 |
| B.若T2°C时,上述反应平衡常数为0.42,则T2<T1 |
| C.在T10C时,若起始时向容器中充入5 mol CO2、5 mol H2、5 mol CH3OH(g)和5 mol H2O(g),则达平衡前v(正)>v(逆) |
D.在T10C时,若起始时向容器中充入4.5molCO2、6mol H2 ,平衡时容器内压强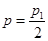 |
在容积不变的密闭容器中存在如下反应2SO2(g)+O2(g)  2SO3(g) ΔH<0,某研究小组探究其他条件下不变时,改变某一条件对上述反应的影响,下列分析正确的是
2SO3(g) ΔH<0,某研究小组探究其他条件下不变时,改变某一条件对上述反应的影响,下列分析正确的是
| A.图Ⅰ表示的是t1时刻增大O2的浓度对反应速率的影响 |
| B.图Ⅱ表示的是t1时刻加入催化剂后对反应速率的影响 |
| C.图Ⅲ表示的是催化剂对平衡的影响,且甲的催化效率比乙的高 |
| D.图Ⅲ表示的是压强对化学平衡的影响,且乙的压强较高 |
在-50℃时,液氨的电离跟水的电离相似,存在平衡,2NH3(l)  NH
NH +NH
+NH ,
,
NH 的平衡浓度为1×10-15 mol·L-1,下列说法错误的是
的平衡浓度为1×10-15 mol·L-1,下列说法错误的是
| A.在液氨中加入NaNH2,可使液氨的离子积变大 |
| B.在液氨中加入NH4Cl,液氨的离子积不变 |
| C.此温度下液氨的离子积K为1×10-30 |
| D.在液氨中加入金属钠可能有NaNH2生成 |
已知C(s)+CO2(g) ="=" 2CO(g) △H>0,反应速率为 ,
,
Zn(s)+2HCl(aq)== ZnCl2 (aq)+H2(g) H<0,反应速率为
H<0,反应速率为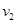 ,
,
对于上述反应,当温度升高时, 和
和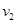 的变化情况为
的变化情况为
| A.同时增大 | B.同时减小 |
C. 增大 增大 减小 减小 |
D. 减小 减小 增大 增大 |