几种短周期元素的原子半径及主要化合价如下表:
| 元素代号 |
X |
Y |
Z |
M |
R |
| 原子半径/nm |
0.186 |
0.102 |
0.075 |
0.074 |
0.143 |
| 主要化合价 |
+1 |
+6 -2 |
+5 -3 |
-2 |
+3 |
已知X是短周期中最活泼的金属,且与R同周期。下列叙述错误的是( )
A.离子半径大小:Y2- > M2- > R3+
B.Z与M组成的化合物是形成酸雨的原因之一
C.将YM2通入BaCl2溶液中有大量白色沉淀产生
D.X、Y、R的最高价氧化物的水化物两两之间能发生反应
下图表示某有机反应过程的示意图,该反应的类型是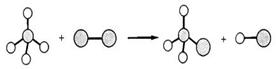
| A.取代反应 | B.加成反应 | C.氧化反应 | D.置换反应 |
下列各图中,表示正反应是吸热反应的图是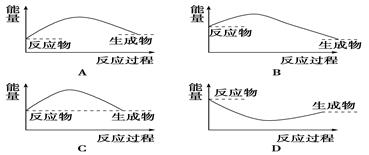
如图为用惰性电极电解CuCl2溶液并验证其产物的实验装置,则下列说法不正确的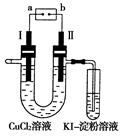
| A.电源a极为负极 |
| B.KI—淀粉溶液会变蓝色 |
| C.若加入适量CuCl2可使电解后的溶液恢复原状态 |
| D.电极Ⅰ上发生的电极反应为:Cu -2e-="=" Cu2+ |
在一定条件下的密闭容器中,加入2molSO2和1molO2,充分反应后能证明反应:2SO2(g)+O2(g) 2SO3(g) 是可逆反应的事实是
2SO3(g) 是可逆反应的事实是
| A.O2仍为1mol | B.SO2仍为2mol |
| C.SO2完全转化为 SO3 | D.SO2、O2、 SO3同时存在 |
化学反应速率的大小主要决定于
| A.反应物的浓度 | B.反应的温度和压强 | C.催化剂 | D.反应物的性质 |