2012年始,雾霾天气无数次肆虐家乡邯郸。其中,燃煤和汽车尾气是造成空气污染的原因之一。
(1)汽车尾气净化的主要原理为:2NO(g) + 2CO(g) 2CO2(g)+ N2(g)。△H<0
2CO2(g)+ N2(g)。△H<0
①该反应平衡常数表达式
②若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是 (填代号)。
(2)直接排放煤燃烧产生的烟气会引起严重的环境问题。
煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOX可以消除氮氧化物的污染。
已知:Ⅰ CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867 kJ/mol
Ⅱ 2NO2(g) N2O4(g) △H=-56.9 kJ/mol
N2O4(g) △H=-56.9 kJ/mol
Ⅲ H2O(g) = H2O(l) ΔH = -44.0 kJ/mol
写出CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式: 。
(3)甲烷燃料电池可以提升能量利用率。下图是利用甲烷燃料电池电解100mL1mol/L食盐水,电解一段时间后,收集到标准状况下的氢气2.24L(设电解后溶液体积不变).
①甲烷燃料电池的负极反应式: 。
②电解后溶液的pH= (忽略氯气与氢氧化钠溶液反应)
③阳极产生气体的体积在标准状况下是 L
氨气是生产化肥、硝酸等的重要原料,围绕合成氨人们进行了一系列研究
(1)氢气既能与氮气又能与氧气发生反应,但是反应的条件却不相同。
(2)已知:2H2 (g) + O2 (g) = 2H2O (g)ΔH =" -483.6" kJ/mol
3H2 (g) + N2 (g)  2NH3 (g)ΔH =" -92.4" kJ/mol
2NH3 (g)ΔH =" -92.4" kJ/mol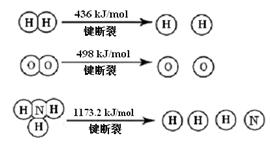
(1)计算断裂1 mol N≡N键需要能量kJ,氮气分子中化学键比氧气分子中的化学键键(填“强”或“弱”),因此氢气与二者反应的条件不同。
(2)固氮是科学家致力研究的重要课题。自然界中存在天然的大气固氮过程:
N2 (g) + O2 (g) =" 2NO" (g)ΔH =" +180.8" kJ/mol ,工业合成氨则是人工固氮。分析两种固氮反应的平衡常数,下列结论正确的是。
| 反应 |
大气固氮 |
工业固氮 |
||||
| 温度/℃ |
27 |
2000 |
25 |
350 |
400 |
450 |
| K |
3.84×10-31 |
0.1 |
5×108 |
1.847 |
0.507 |
0.152 |
A.常温下,大气固氮几乎不可能进行,而工业固氮非常容易进行
B.人类大规模模拟大气固氮是无意义的
C.工业固氮温度越低,氮气与氢气反应越完全
D.K越大说明合成氨反应的速率越大
(3)在恒温恒容密闭容器中按照甲、乙两种方式分别投料(物质的量如下表)所示,发生反应:3H2 (g) + N2 (g)  2NH3 (g)测得甲容器中H2的转化率为40%。
2NH3 (g)测得甲容器中H2的转化率为40%。
| N2 |
H2 |
NH3 |
|
| 甲 |
1 |
3 |
0 |
| 乙 |
0.5 |
1.5 |
1 |
①3H2 (g) + N2 (g) 2NH3 (g)的平衡常数表达式。
2NH3 (g)的平衡常数表达式。
②判断乙容器中反应进行的方向。(填“正向”或“逆向”)
(4)氨气是合成硝酸的原料,写出氨气与氧气反应生成一氧化氮和气态水的热化学方程式。
短周期元素Q、R、T、W在元素周期表中的位置如图所示,期中T所处的周期序数与主族序数相等,请回答下列问题:
(1)T的原子结构示意图为_______。
(2)元素的非金属性为(原子的得电子能力):Q______W(填“强于”或“弱于”)。
(3)W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,反应的化学方程式为_____。
(4)原子序数比R多1的元素是一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是__________。
(5)R有多种氧化物,其中甲的相对分子质量最小。在一定条件下,2L的甲气体与0.5L的氯气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的R的含氧酸盐的化学式是__________。
(6)在298K下,Q、T的单质各1mol完全燃烧,分别放出热量aKJ和bKJ。又知一定条件下,T的单质能将Q从它的最高价氧化物中置换出来,若此置换反应生成3molQ的单质,则该反应在298K下的 =________(注:题中所设单质均为最稳定单质)。
=________(注:题中所设单质均为最稳定单质)。
(13分)已知A、B、C、D、E、F是含有同一种元素的化合物,其中F是能使湿润红色石蕊试纸变蓝的气体,它们之间能发生如下反应:①A+H2O→B+C ②C+F→D ③D+NaOH F+E+H2O
F+E+H2O
(1)写出它们的化学式:A________、B________、C________、D________、E________、F________;
(2)写出各步反应的化学方程式,并指出反应①的氧化剂和还原剂。
①________________________,氧化剂________、还原剂________。
②________________________。
③________________________。
(3)工业生产C的过程中有如下一步反应,即F经催化氧化生成B和H2O,写出该步反应的化学方程式________________________。
某些有机化合物之间具有如下转化关系: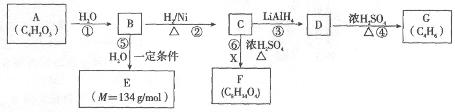
其中A是一种五元环状化合物,其分子中只有一种化学环境的氢原子;F核磁共振氢谱显示有三种化学环境的氢原子,且峰面积之比为2:2:3。
已知:①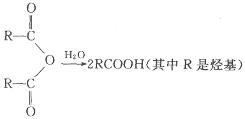
②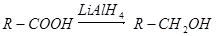 (其中R是烃基)
(其中R是烃基)
(1)G是合成顺丁橡胶的主要原料,G的名称是__________。B中含氧官能团的名称是__________。
(2)A的结构简式是__________。
(3)⑥的化学方程式是__________。
(4)E在一定条件下能够发生缩聚反应,其中主链上含“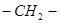 ”的高聚物的结构简式是__________。有机物Y与E互为同分异构体,且具有相同的官能团种类和数目,则Y的结构可有__________种。
”的高聚物的结构简式是__________。有机物Y与E互为同分异构体,且具有相同的官能团种类和数目,则Y的结构可有__________种。
实验室里用硫酸厂烧渣(主要成分为铁的氧化物及少量 、
、 等)制备聚铁(碱式硫酸铁的聚合物)和绿矾(
等)制备聚铁(碱式硫酸铁的聚合物)和绿矾( ),其过程如下:
),其过程如下:
请回答下列问题:
(1)过程①中, 和
和 、
、 反应的化学方程式是______________。
反应的化学方程式是______________。
(2)过程②中产生的气体会对大气造成污染,可选用下列试剂中的_________吸收(填字母)。
a.浓 b.蒸馏水 c.
b.蒸馏水 c. 溶液 d.浓硝酸
溶液 d.浓硝酸
(3)过程③中,需要加入的物质名称是_____________。
(4)过程④中的实验操作是__________________________。
(5)过程⑥中,将溶液Z加热到70~80℃,目的是__________________________。
(6)实验室为测定所得到的聚铁样品中铁元素的质量分数,进行下列实验。①用天平称取样品 ;②将样品溶于足量盐酸后,加入足量的氯化钡溶液;③过滤、洗涤、干燥,称量,得固体质量为3.495g。若该聚铁主要成分为
;②将样品溶于足量盐酸后,加入足量的氯化钡溶液;③过滤、洗涤、干燥,称量,得固体质量为3.495g。若该聚铁主要成分为
 ,则该聚铁中铁元素的质量分数为_____________(精确至0.01%)。
,则该聚铁中铁元素的质量分数为_____________(精确至0.01%)。