被称之为“软电池”的纸质电池,其电池总反应为Zn+2MnO2+H2O ZnO+2MnO(OH)。下列说法正确的是( )
ZnO+2MnO(OH)。下列说法正确的是( )
| A.该电池的正极为锌 |
| B.该电池反应中二氧化锰起催化剂作用 |
| C.当65 g Zn完全溶解时,流经电极的电子为1mol |
D.电池正极反应式为2MnO2+2e-+2H2O 2MnO(OH)+2OH- 2MnO(OH)+2OH- |
草酸是二元中强酸,草酸氢钠溶液显酸性。常温下,向10 mL 0.01 mol/L NaHC2O4溶液中滴加0.01 mol/L NaOH溶液,随着NaOH溶液体积的增加,溶液中离子浓度关系正确的是
| A.V(NaOH) = 0时,c(H+)=" 1×" 10-2 mol/L |
| B.V(NaOH) < 10 mL时,不可能存在c(Na+) ="2" c(C2O42-)+2 c(HC2O4-) |
| C.V(NaOH)> 10 mL时,c(H+)=" 1" × 10-7mol/L |
| D.V(NaOH)> 10 mL时,c(Na+)> c(C2O42-)>c(HC2O4-) |
下列说法正确的是
| A.在Na2CO3、NaHCO3两溶液中,离子种类不相同 |
| B.在等体积、等物质的量浓度的Na2CO3、NaHCO3两溶液中,阳离子总数相等 |
| C.在NaHCO3溶液中一定有c(Na+)+c(H+)=c(HCO3-)+c(OH-)+2c(CO32-) |
| D.在Na2CO3溶液中一定有c(Na+)> c(HCO3-)> c(H+)> c(OH-) |
用0.01mol·L-1 H2SO4和0.01mol·L-1NaOH溶液,中和后加水至100mL。若在滴定时终点有误差:(1)多滴了1滴H2SO4;(2)少滴了1滴H2SO4(1滴为0.05 mL),则(1)和(2)两种情况下c(H+)之比的值是
| A.10 | B.50 | C.5×103 | D.104 |
已知常温下BaSO4(分子量233)的溶解度为2.33×10-4g,则其Ksp为
| A.2.33×10-4 | B.1×10-5 | C.1×10-10 | D.1×10-12 |
MOH和ROH两种一元碱的溶液分别加水稀释时,pH变化如下图所示。下列叙述中不正确的是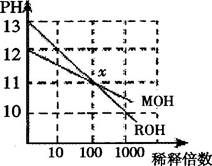
| A.ROH是一种强碱 | B.在x点,MOH并没有完全电离 |
| C.在x点,c(M+)=c(R+) | D.稀释前,c(ROH)=10c(MOH) |