T10C 时,将9molCO2和12molH2充入3L密闭容器中,发生反应CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH <0,容器中CH3OH的物质的量随时间变化如曲线I所示,平衡时容器内压强为P。改变某一条件重新进行上述反应,CH3OH的物质的量随时间变化如曲线II所示。下列说法正确的是
CH3OH(g)+H2O(g) ΔH <0,容器中CH3OH的物质的量随时间变化如曲线I所示,平衡时容器内压强为P。改变某一条件重新进行上述反应,CH3OH的物质的量随时间变化如曲线II所示。下列说法正确的是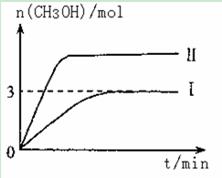
| A.曲线II对应的条件改变是减小压强 |
| B.若T2°C时上述反应的平衡常数为0.42,则T2< T1 |
| C.在T10C,若起始时向容器中充入5 mol CO2、5 mol H2、5 mol CH3OH(g)和 5 mol H2O(g),则达平衡前v(正)>v(逆) |
| D.在T10C,若起始时向容器中通入4 .5 molCO2、6mol H2 ,平衡时容器内的压强P1=P/2 |
下列化学反应的离子方程式正确的是()
| A.氢氧化镁中滴加盐酸:H++OH-=H2O |
| B.用FeCl3溶液腐蚀铜电路板:Fe3++Cu=Fe2++Cu2+ |
| C.在硫酸氢钾溶液中加入氢氧化钡溶液至pH=7:H++SO42-+Ba2++OH-=BaSO4↓+H2O |
| D.NH4HCO3溶液中加入过量NaOH溶液并加热: |
NH4++HCO3-+2OH-△NH3+CO32-+2H2O
在c(H+)∶c(OH-)=1∶2的水溶液中能大量共存的离子组是 ( )
| A.K+、Al3+、HCO3—、SO42- |
| B.Ca2+、NH4+、CO32-、Cl- |
| C.Na+、K+、NO3-、ClO- |
| D.Na+、Fe2+、I-、SO32- |
在反应3Cl2 + 8NH3 → 6NH4Cl + N2中,设阿伏加德罗常数为NA。则下列说法正确的是()
| A.若有0.3 mol Cl2参加反应,转移的电子数为0.6NA |
| B.若生成2.24 L氮气,转移的电子数为0.6NA |
| C.若有1.2NA个电子发生转移,则被氧化的氨气的质量是27.2 g |
| D.若生成1 mol的氯化铵转移电子数是n个,则NA=1/n |
某物质A加热分解,产物都是气体,化学方程式为2A B+2C+2D。测得生成的混合气体对氢气的相对密度为d,则A的相对分子质量为( )
B+2C+2D。测得生成的混合气体对氢气的相对密度为d,则A的相对分子质量为( )
A.7d B.5d C.2.5d D.2d
一元中强酸次磷酸(H3PO2)是一种精细化工产品,下列说法正确的是( )
A.次磷酸的电离方程式为H3PO2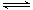 3H++PO23- 3H++PO23- |
| B.次磷酸中P的化合价为+1 |
| C.NaH2PO2是酸式盐 |
| D.NaH2PO2溶液显弱酸性 |