下列反应进行分类时,既属于氧化还原反应又属于置换反应的是
| A.Zn+H2SO4=ZnSO4+H2↑ | B.2KClO3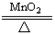 2KCl+3O2↑ 2KCl+3O2↑ |
C.S+O2 SO2 SO2 |
D.CH4+2O2 CO2+2H2O CO2+2H2O |
在元素周期表中金属与非金属的分界处,可以找到( )
| A.合金 | B.半导体材料 | C.催化剂 | D.农药 |
通常用来衡量一个国家的石油化学工业发展水平的标志是()
| A.石油产量 | B.乙烯的产量 | C.合成纤维的产量 | D.硫酸的产量 |
许多国家十分重视海水资源的综合利用。不需要化学变化就能够从海水中获得的物质是
| A.氯、溴、碘 | B.钠、镁、铝 | C.食盐、淡水 | D.烧碱、氢气 |
下列过程没有发生化学反应的是
| A.用含硅胶、铁粉的透气小袋与食品一起密封包装 |
| B.用热碱水清除炊具上残留的油污 |
| C.用浸泡过高锰酸钾溶液的硅藻土保存水果 |
| D.用活性炭去除冰箱中的异味 |
800℃时在2L密闭容器内反应:2NO(g)+O2(g) 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
| 时间/s |
0 |
1 |
2 |
3 |
4 |
5 |
| n(NO)/mol |
0.020 |
0.010 |
0.008 |
0.007 |
0.007 |
0.007 |
(1)达平衡时NO的转化率_________________。
(2)下图中表示NO2的变化的曲线是________,
用O2表示从0~2s内该反应的平均速率v(O2)=_____。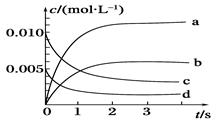
(3)能说明该反应一定达到平衡状态的是__
A.v(NO2)=2v(O2) B.容器内颜色保持不变
C.2V逆(NO)=v正(O2)D.容器内压强保持不变
(4)能增大该反应的反应速率是
A.及时分离出NO2气体 B.适当升高温度
C.增大O2的浓度 D.选择高效催化剂