下列叙述I和II均正确并且有因果关系的是
| 选项 |
叙述I |
叙述II |
| A |
相同条件下NaHCO3的溶解度比Na2CO3的小 |
向饱和Na2CO3溶液中通入足量CO2,溶液变浑浊 |
| B |
钠比铜的金属性强 |
金属钠可从硫酸铜溶液中置换出铜单质 |
| C |
常温下铝与浓硫酸、浓硝酸均不反应 |
可用铝槽车密封运送浓硫酸、浓硝酸 |
| D |
合成氨反应为吸热反应 |
该反应需在高温条件下进行 |
某溶液中含有较大量的Cl-、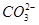 、OH-三种阴离子,如果只取一次该溶液就能够分别将三种阴离子依次检验出来,下列实验操作顺序正确的是 ( )
、OH-三种阴离子,如果只取一次该溶液就能够分别将三种阴离子依次检验出来,下列实验操作顺序正确的是 ( )
①滴加Mg(NO3)2溶液 ②过滤 ③滴加AgNO3溶液 ④滴加Ba(NO3)2溶液
| A.①②④②③ | B.④②①②③ |
| C.①②③②④ | D.④②③②① |
某一无色晶体,要鉴定它是否为硫酸铵,下列操作必要的是 ( )
| A.加入NaOH溶液并加热,用湿润的红色石蕊试纸检验产生气体的性质 |
| B.加热观察有无气体放出 |
| C.晶体用蒸馏水溶解,用硝酸酸化,再加入BaCl2观察有无沉淀生成 |
| D.晶体溶解,加入稀盐酸无现象,再加入BaCl2溶液看有无沉淀生成 |
下列被检测物质和对应的试剂正确的是 ( )
| A.KI——淀粉 |
| B.Cl-——硝酸酸化的硝酸银溶液 |
C. ——BaCl2溶液 ——BaCl2溶液 |
| D.H+——酚酞 |
某校学生用化学知识解决生活中的问题,下列家庭小实验不合理的是 ( )
| A.用食醋除去暖水瓶中的薄层水垢 |
| B.用米汤检验含碘盐中的碘酸钾(KIO3) |
| C.用食用碱(Na2CO3)溶液洗涤餐具上的油污 |
| D.用闻气味的方法区别白酒和白醋 |
不用其他试剂,用最简单的方法鉴别下列五种物质的溶液:①NaOH;②MgSO4;③FeCl3;④Ba(NO3)2;⑤KCl。则正确的鉴别顺序是 ( )
| A.②④③①⑤ | B.③①②④⑤ |
| C.①③②④⑤ | D.③②④①⑤ |