室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如下表:
| 实验编号 |
起始浓度/(mol·L-1) |
反应后溶液的pH |
|
| c(HA) |
c(KOH) |
||
| ① |
0.1 |
0.1 |
9 |
| ② |
x |
0.2 |
7 |
下列判断不正确的是( )
A.实验①反应后的溶液中:c(K+) > c(A—) > c(OH—) > c(H+)
B.实验①反应后的溶液中:c(OH—) = c(K+) — c(A—) =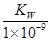 mol/L
mol/L
C.实验②反应后的溶液中:c(A—) + c(HA) > 0.1 mol/L
D.实验②反应后的溶液中:c(K+) = c(A—) > c(OH—) = c(H+)
下列各溶液与强酸溶液反应,不能用离子方程式HCO3―+H+=CO2↑+H2O 表示的是( )
| A.碳酸氢钾溶液 | B.纯碱溶液 | C.碳酸氢钙溶液 | D.小苏打溶液 |
下列各组物质中的两种物质作用时,反应条件或反应物用量的改变,对生成物没有影响的是()
| A.Na2O2和CO2 | B.Na和O2 | C.NaOH和CO2 | D.C和O2 |
为制备干燥、纯净的CO2,将大理石和盐酸反应生成的气体先后通人装有下列物质的两个吸收装置,两个装置应依次装人()
| A.水;无水CaCl2固体 | B.饱和NaHCO3溶液;浓H2SO4 |
| C.浓H2SO4;饱和NaHCO3溶液 | D.饱和NaHCO3溶液;稀H2SO4 |
在下列物质中,受热能放出某气体A,并将所得残渣与盐酸反应又能生成气体A的化合物是( )
| A.NH4HCO3 | B.K2CO3 | C.Ca(HCO3)2 | D.KClO3 |
把铁放入下列溶液中,铁溶解而溶液质量减轻的是()
| A.FeCl3 | B.稀H2SO4 | C.热的 NaOH溶液 | D.CuSO4 |