将一定量的氯气通入30mL浓度为10.00mol/L的氢氧化钠浓溶液中,加热少许时间后溶液中形成NaCl、NaClO、NaClO3共存体系。下列判断正确的是( )
| A.与NaOH反应的氯气一定为0.3 mol |
| B.反应后的溶液中n(Na+):n(Cl-)可能为7:3 |
| C.若反应中转移的电子为n mol,则0.15<n<0.25 |
| D.n(NaCl):n(NaClO):n(NaClO3)可能为11﹕2﹕1 |
已知反应X(g)+Y(g) R(g)+Q(g)的平衡常数与温度的关系如表.830℃时,向一个2 L的密闭容器中充入0.2 mol X和0.8 mol Y,反应初始4 s内v(X)=0.005mol/(L•s).下列说法正确的是
R(g)+Q(g)的平衡常数与温度的关系如表.830℃时,向一个2 L的密闭容器中充入0.2 mol X和0.8 mol Y,反应初始4 s内v(X)=0.005mol/(L•s).下列说法正确的是
| 温度/℃ |
700 |
800 |
830 |
1000 |
1200 |
| 平衡常数 |
1.7 |
1.1 |
1.0 |
0.6 |
0.4 |
A.4s时容器内c(Y)="0.76" mol/L
B.830℃达平衡时,X的转化率为80%
C.反应达平衡后,升高温度,平衡正向移动
D.1200℃时反应R(g)+Q(g) X(g)+Y(g)的平衡常数K=0.4
X(g)+Y(g)的平衡常数K=0.4
下列叙述Ⅰ和Ⅱ均正确并且有因果关系的是
| 选项 |
叙述Ⅰ |
叙述Ⅱ |
| A |
Cl2具有漂白性 |
Cl2能使干燥的有色布条褪色 |
| B |
F元素非金属性很强 |
HF是一种强酸 |
| C |
浓H2SO4有强氧化性,SO2具有较强的还原性 |
但浓H2SO4却能干燥SO2 |
| D |
乙醇能杀菌消毒 |
医药上选用纯酒精进行消毒 |
已知丙烷的二氯代物C3H6Cl2有4种同分异构体,则分子式为C3H2Cl6的同分异构体共有(不考虑立体异构)
| A.3种 | B.4种 | C.5种 | D.6种 |
下列实验方案、现象和结论均正确的是
| 选项 |
实验方案 |
现象 |
结论 |
| A |
 |
向里推活塞时,长颈漏斗中有一段水柱,静止,水柱高度不变 |
该装置的气密性良好 |
| B |
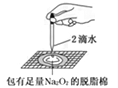 |
脱脂棉燃烧 |
Na2O2与水反应生成氢氧化钠和氧气 |
| C |
 |
烧杯①的澄清石灰水先变浑浊 |
NaHCO3比Na2CO3受热更易分解 |
| D |
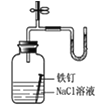 |
U形管右端的液面高 |
铁钉发生吸氧腐蚀 |
SO2有毒,但葡萄酒里都含有SO2,起保鲜、杀菌和抗氧化作用.下列说法不正确的是
| A.葡萄酒中的SO2对人体无害,是因为它的含量很少 |
| B.葡萄酒中的SO2具有抗氧化作用,是因为它具有较强的还原性 |
| C.从红葡萄酒的颜色判断,其中的SO2没有漂白性 |
| D.葡萄酒倒入酒杯摇一摇,可以减少其中SO2的含量 |