短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中,T所处的周期序数与主族序数相等,请回答下列问题: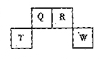
(1)T的原子结构示意图为
(2)元素的非金属性为(原子的得电子能力):Q ______ W(填“强于”或“弱于”)。
(3)W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,反应的化学方程式为 。
(4)原子序数比R多1的元素的一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是 。
(5)R有多种氧化物,其中甲的相对分子质量最小。在一定条件下,2L的甲气体与0.5L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的R的含氧酸盐只有一种,则该含氧酸盐的化学式是
(6)在298K下,Q、T的单质各1mol完全燃烧,分别放出热量aKJ和bKJ。又知一定条件下,T的单质能将Q从它的最高价氧化物中置换出来,若此置换反应生成3molQ的单质,则该反应在298K下的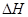 = ( 注:题中所涉单质均为最稳定单质)。
= ( 注:题中所涉单质均为最稳定单质)。
在试管里放入一块铜片,注入一定体积的浓硫酸,给试管加热,使之反应。
(1)若铜片还有剩余,硫酸__ __消耗完毕(填“已”或“没有”)。其理由是
。
(2)用一定量的废铜屑制取胆矾,有两种方法:第一种是取Cu与浓H2SO4直接反应;第二种是先将铜在空气中加热使之生成CuO,再与稀H2SO4反应,其中__种方法好,理由是____ ____。
将a mol的Na2O2和b mol NaHCO3固体混合后,在密闭容器中加热到250℃,让其充分反应。
(1)当剩余固体为Na2CO3,排出气体为O2,H2O时,a:b的值为________。
(2)当剩余固体为Na2CO3,NaOH,排出气体为O2,H2O时,a:b的值为________。
(3)当a:b>1时,剩余固体为________,排出气体为________。
(4)当排出的O2和H2O为等物质的量时,则a:b的值为________。
有A、B、C、D、E和F六瓶无色溶液,他们是中学化学中常用的无机试剂。纯E为无色油状液体;B、C、D和F是盐溶液,且他们的阴离子均不同。现进行如下实验:
①A有刺激性气味,用沾有浓盐酸的玻璃棒接近A时产生白色烟雾;
②将A分别加入其它五中溶液中,只有D、F中有沉淀产生;继续加入过量A时,D中沉淀无变化,F中沉淀完全溶解;
③将B分别加入C、D、E、F中,C、D、F中产生沉淀,E中有无色、无味气体逸出;
④将C分别加入D、E、F中,均有沉淀生成,再加入稀HNO3,沉淀均不溶。
根据上述实验信息,请回答下列问题:
(1)能确定溶液是(写出溶液标号与相应溶质的化学式):
(2)不能确定的溶液,写出其标号、溶质可能的化学式及进一步鉴别的方法:
已知A、B、D、E均为中学化学常见单质或化合物,它们之间的转换关系如下图所示(部分产物略去)。
(1)若A为单质,组成A单质的元素是自然界中形成化合物种类最多的元素。
①B属于分子(填“极性”或“非极性”),B分子中所有原子是否都满足8电子结构,(填“是”或“否”)。
②向50 mL 4 mol/L的NaOH溶液中通入1.12 L B(标准状况),反应后溶液中的溶质为_______(填化学式),物质的量分别为_____________。
(2)若A为第三周期中的元素所形成的氯化物。
①写出A溶液→B的离子方程式。
②写出A和B在溶液中反应的离子方程式。
(3)若A为常见的金属,在E的冷、浓溶液中有钝化现象。已知:X为含有非极性键的离子化合物,且1 mol X含有38 mol电子,向D溶液中加入与D等物质的量的固体X,该反应的离子方程式为。
盐酸、硫酸和硝酸是中学阶段常见的三种强酸。请就三者与金属铜的反应情况,回答下列问题:
(1)
①在100mL 18molL-1的 浓硫酸中加入过量的铜片,加热使之充分反应,产生的气体在标准状况下的体积可能是。
浓硫酸中加入过量的铜片,加热使之充分反应,产生的气体在标准状况下的体积可能是。
A.40.32L B.30.24L C.20.16L D.6.72L
②若使上述反应①中剩余的铜片继续溶解,可向其中加入硝酸钠,写出反应的离子方程式。
(2)若将过量铜粉与一定量浓硝酸反应,当反应完全停止时,共收集到的气体1.12L(标准状况),则该气体的成分是 ,反应中所消耗的硝酸的物质的量可能为。
A.0.1mol B.0.15mol C.0.2mol D.0.25mol
(3)某同学向浸泡铜片的稀盐酸中加入H2O2后,铜片溶解,并且该反应的产物只有氯化铜和水。该反应的化学方程式为。