新型锂离子电池在新能源的开发中占有重要地位。可用作节能环保电动汽车的动力电池。磷酸亚铁锂(LiFePO4)是新型锂离子电池的首选电极材料,它的制备方法如下:
方法一:将碳酸锂、乙酸亚铁[(CH3COO)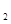 Fe]、磷酸二氢铵按一定比例混合、充分研磨后,在800℃左右、惰性气体氛围中煅烧制得晶态磷酸亚铁锂,同时生成的乙酸及其它产物均以气体逸出。
Fe]、磷酸二氢铵按一定比例混合、充分研磨后,在800℃左右、惰性气体氛围中煅烧制得晶态磷酸亚铁锂,同时生成的乙酸及其它产物均以气体逸出。
方法二:将一定浓度的磷酸二氢铵、氯化锂混合溶液作为电解液,以铁棒为阳极,石墨为阴极,电解析出磷酸亚铁锂沉淀。沉淀经过滤、洗涤、干燥,在800℃左右、惰性气体氛围中煅烧制得晶态磷酸亚铁锂。
在锂离子电池中,需要一种有机聚合物作为正负极之间锂离子迁移的介质,该有机聚合物的单体之一(用M表示)的结构简式如下: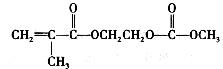
请回答下列问题:
(1)上述两种方法制备磷酸亚铁锂的过程都必须在惰性气体氛围中进行。其原因是 。
(2)在方法一所发生的反应中, 除生成磷酸亚铁锂、乙酸外, 还有 、 、 (填化学式)生成。
(3)在方法二中,阳极生成磷酸亚铁锂的电极反应式为 。
(4)写出M与足量氢氧化钠溶液反应的化学方程式: 。
(5)已知该锂离子电池在充电过程中,阳极的磷酸亚铁锂生成磷酸铁,则该电池放电时正极的电极反应式为 。
X、Y、Z、W四种短周期元素在周期表中的位置关系如图:
I.若Z元素原子的最外层电子数是电子层数的2倍
(1)写出铜和X的最高价氧化物水化物稀溶液反应的离子方程式 。
(2)W最高价氧化物水化物的浓溶液不稳定,受热可分解,产物之一是黄绿色气体,且当有28mol电子转移时,共产生9 mol气体,写出该反应的化学方程式 。
Ⅱ,若Y和Z的核外电子数之和为22。
(3)Y的气态氢化物电子式为: 工业合成该物质的化学方程式为 。
(4)X单质与W的最高价氧化物水化物的浓溶液反应,当电子转移0.4mol时,产生气体的体积(标准状况下)是 。
将晶体X加热分解,可得A、B、D、E、F和水六种产物,其中A、B、D都是中学化学中常见的氧化物,气体E是单质F所含元素的氢化物。
(1)A能溶于强酸、强碱,写出A与强碱溶液反应的离子方程式 。
(2)B、D都是酸性氧化物且组成元素相同,D溶于水得强酸,则B、D分子中除氧元素外所含另一种元素在周期表中的位置是 。
(3)E能使湿润的红色石蕊试纸变蓝,实验室制取E气体的化学方程式为 ,制得的气体可用如图所示装置收集,则气体应从 (填“A”或“B”)通人。
(4)由各分解产物的物质的量之比推测X的组成类似于明矾,若向X的浓溶液中滴加浓NaOH溶液至过量,现象依次为 、 。
(5)取一定量的X晶体分解,若生成F 1 mol,则必同时生成 物质 mol.
将5.3 g某碱式碳酸盐固体(不含结晶水)M溶解于100 g 9.8%的稀硫酸中,充分反应后得到 224 mL CO2(标准状况)和含有MgSO4、Al2(SO4)3的溶液。向所得溶液中逐滴加入NaOH溶液,产生沉淀的质量与加入的溶质NaOH的质量关系如图所示。
(1)由图可知,固体M与稀硫酸反应后所得溶液中除含有溶质MgSO4和Al2 (SO4)3外,还含有的溶质是 (写化学式)。
(2)加入的溶质NaOH从x g到8.8 g所发生反应的离子方程式为 。
(3)当加入溶质NaOH的质量到xg时,生成Al(OH)3的质量为 g,x= 。
(4)M的化学式为 。
铁是目前人类使用量最大的金属,它能形成多种化合物。
(1)取5.6 g的生铁与足量的稀硫酸混合反应,无论怎样进行实验,最终收集了的气体体积均小于2.24 L(标准状况),最主要的原因是__________,所得溶液在长时间放置过程中会慢慢出现浅黄色,试用离子方程式解释这一变化的原因____________。
(2)ZnFe2Ox是一种新型纳米材料,可将工业废气中的某些元素转化为游离态,制取纳米ZnFe2Ox 和用于除去废气的转化关系如图 。若上述转化反应中消耗的
。若上述转化反应中消耗的 ,x的值为_________________。请写出 ZnFe2Ox与NO2反应的化学方程式______________(x用前一问求出的具体值)。
,x的值为_________________。请写出 ZnFe2Ox与NO2反应的化学方程式______________(x用前一问求出的具体值)。
(3)LiFePO4(难溶干水)材料被视为最有前途的锂离子电池材料之一。
①以 FePO4(难溶于水)、Li2CO3、单质碳为原料在高温下制备LiFePO4 ,,该反应还生成一种可燃性气体,则反应方程式为____________.
②磷酸铁锂动力电池有几种类型,其中一种(中间是锂离子聚合物的隔膜,它把正极与负桩隔开)工作原理为 。则放电时正极上的电极反应式为___________.
。则放电时正极上的电极反应式为___________.
(4)已知25℃时,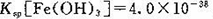 ,此温度下若在实验室中配制5 mol/L 100 mL FeCl3溶液,为使配制过程中不出现浑浊现象,则至少需要加人2 mol/L的盐酸__________ml(忽略加入盐酸体积)。
,此温度下若在实验室中配制5 mol/L 100 mL FeCl3溶液,为使配制过程中不出现浑浊现象,则至少需要加人2 mol/L的盐酸__________ml(忽略加入盐酸体积)。
有A、B、C、D、E、F六种元素。已知:
①它们位于三个不同的短周期,核电荷数依次增大。
②B与F同主族。
③B、C分别都能与D按原子个数比1∶1或1∶2形成化合物。
④A、E分别都能与D按原子个数比1∶1或2∶1形成化合物。
⑤E元素的电离能数据如下 (kJ·mol-1):
| I1 |
I2 |
I3 |
I4 |
… |
| 496 |
4562 |
6912 |
9540 |
… |
(1)写出只含有A、B、D、E四种元素的两种无水盐的化学式________、________。
(2)B2A4分子中存在______个σ键,______个π键。
(3)人们通常把拆开1 mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可以用于计算化学反应的反应热(ΔH),化学反应的ΔH等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。下表列出了上述部分元素形成的化学键的键能:
| 化学键 |
A—A |
C—C |
A—C |
| 键能/kJ·mol-1 |
436 |
946 |
390.8 |
试计算A单质与C单质反应生成CA3时的反应热ΔH=_____ (要写单位)。