某化学科研小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如下变化规律(图中P表示压强,T表示温度,n表示物质的量):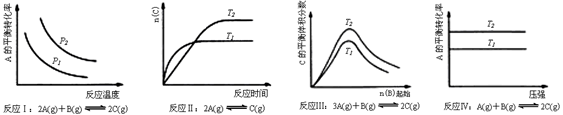
根据以上规律判断,下列结论正确的是
| A.反应Ⅰ:△H>0,p2>p1 |
| B.反应Ⅱ:△H>0,T1>T2 |
| C.反应Ⅲ:△H>0,T2>T1;或△H<0,T2<T1 |
| D.反应Ⅳ:△H<0,T2>T1 |
向一定量的Fe、FeO、Fe3O4的混合物中加入100 mL 1.0 mol·L-1的盐酸,恰好使混合物完全溶解,放出224 mL的气体(标准状况),所得溶液中加入KSCN溶液后无血红色出现,若用足量的CO在高温下还原相同质量的此混合物,能得到铁的质量是()
| A.11.2 g | B.5.6 g | C.2.8 g | D.1.4 g |
用惰性电极电解M(NO3)x的水溶液,当阴极上增重a g时,在阳极上同时产生b L氧气(标准状况),从而可知M的相对原子质量为()
A.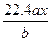 |
B.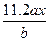 |
C.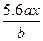 |
D.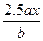 |
如下图是电解CuCl2溶液的装置,其中c、d为石墨电极。则下列有关的判断正确的是()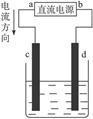
| A.a为负极、b为正极 |
| B.a为阳极、b为阴极 |
| C.电解过程中,d电极质量增加 |
| D.电解过程中,氯离子浓度不变 |
家用炒菜铁锅用水清洗放置后,出现红棕色的锈斑,在此变化过程中不发生的化学反应是()
| A.4Fe(OH)2+2H2O+O2====4Fe(OH)3 |
| B.2Fe+2H2O+O2====2Fe(OH)2 |
| C.2H2O+O2+4e-====4OH- |
| D.Fe-3e-====Fe3+ |
下列实验操作中:①制备Fe(OH)2,用胶头滴管将NaOH溶液滴入FeSO4溶液中;②制备氢气,简易装置中长颈漏斗的下端管口;③分馏石油时,测量温度所用的温度计;④用乙醇制乙烯时所用的温度计;⑤用水吸收氨气时的导气管;⑥向试管中的BaCl2溶液中滴加稀硫酸。仪器需插入液面下的有()
| A.①②④ | B.③⑤ | C.③⑤⑥ | D.①②③④⑤⑥ |