下列离子方程式不正确的是( )
| A.用稀硫酸除去铜绿:4H++Cu2(OH)2CO3=2Cu2++CO2↑+3H2O |
| B.将Na2O2固体投入H218O中:2H218O+2Na2O2=4OH-+4Na++18O2↑ |
| C.向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液恰好使SO42—完全沉淀: 2Ba2++NH4++Al3++2SO42—+4OH-= Al(OH)3↓+NH3·H2O+2BaSO4↓ |
| D.向Na2FeO4溶液中加入稀硫酸产生氧气:4FeO42—+20H+ = 4Fe3++3O2↑+10H2O |
化学是以实验为基础的学科,下列各图示实验不合理的是()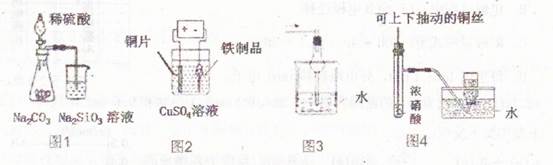
| A.图1为证明非金属性强弱:S>C>Si |
| B.图2为在铁制品表面镀铜 |
| C.图3可用于吸收氯化氢、溴化氢等气体 |
| D.图4为制备并收集少量NO2气体 |
除去下列物质中的少量杂质(括号内的物质为杂质),所选出的试剂或方法不正确的是()
A.CO2(SO2):饱和碳酸氢钠溶液 B.N2(O2):灼热的铜网
B.Al2O3(SiO2):NaOH溶液 D.Na2CO3固体(NaHCO3):加热
下列离子方程式正确的是()
| A.亚硫酸氢铵溶液中滴加少量NaOH溶液:NH4++OH-=NH3.H2O |
| B.酸性KI淀粉溶液久置后变蓝4I-+O2+2H2O=2I2+4OH- |
| C.铜溶于稀硝酸中:Cu+4H++2NO3- = Cu2++2NO2↑+2H2O |
| D.NaHCO3溶液中加足量Ba(OH)2溶液:HCO3-+Ba2++OH-=BaCO3↓+H2O |
在指定条件下,下列粒子一定能大量共存的是()
| A.使酚酞变红色的溶液中:Na+、Fe3+、SO42-、Cl- |
| B.饱和氯水中:K+、Na+、Cl-、HSO3- |
| C.室温下,pH=13的溶液中:Na+、K+、SiO32-、Cl- |
| D.1.0mol/L的KNO3溶液:H+、Fe2+、Cl-、SO32- |
下列化合物既能通过单质间的化合反应制得,又能通过单质和稀盐酸反应制得的是()
| A.FeCl2 | B.CuCl2 | C.AlCl3 | D.FeCl3 |