在酸性溶液中,一定能大量共存的离子组是
| A.Na+、NH4+、NO3— 、SO42— |
| B.Na+、Cu2+、Cl-、HCO3— |
| C.Fe2+、Ag+、 I-、NO3— |
| D.K+、Al3+ 、Ba2+、SO42— |
室温下,用0.100 mol•L-1 NaOH溶液分别滴定20.00ml 0.100 mol•L-1的盐酸和醋酸,滴定曲线如图所示,下列说法不正确的是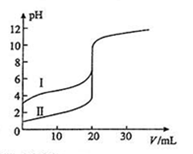
| A.Ⅱ表示的是滴定盐酸的曲线 |
| B.PH=7时,滴定盐酸消耗V(NaOH)大于滴定醋酸消耗V(NaOH) |
| C.V(NaOH) =20ml时,C(Cl—) ==C(CH3COO—) |
| D.V(NaOH) =10ml时,醋酸溶液中:C(CH3COO—)>C(Na+)> C(H+ )> C(OH—) |
短周期元素W、X、Y、Z的原子序数依次增大,其简单离子都能破坏水的电离平衡的是
| A.Y3+、Z2﹣ | B.X+、Z2﹣ | C.X+、Y3+ | D.W2﹣、X+ |
常温下,下列各组离子在指定溶液中一定能大量共存的是
| A.pH=1的溶液中:Fe2+、NO3-、SO42-、Na+ |
| B.某无色溶液中: NH4+、Al3+、HCO3-、Cl- |
| C.澄清透明溶液中:K+、Fe3+、SO42-、NO3- |
| D.由水电离的c (H+)=1×10-14 mol•L-1的溶液中:Ca2+、K+、Cl-、HCO3- |
下列叙述正确的是
| A.2CH3CH2OH(l)+6O2(g)═4CO2(g)+6H2O(l) △H=﹣1367 kJ·mol-1,则乙醇燃烧热△H=﹣1367 kJ·mol-1 |
| B.放热反应的反应速率总是大于吸热反应的反应速率 |
| C.应用盖斯定律,可计算某些难以直接测量的反应的焓变 |
| D.同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H不同 |
下列生产、生活等实际应用,不能用勒夏特列原理解释的是
| A.合成氨工业通常采用20 MPa~50 MPa压强,以提高原料的利用率 |
| B.合成氨工业中采用500℃反应温度,有利于氨的合成 |
| C.合成三氧化硫过程中使用过量的氧气,以提高二氧化硫的转化率 |
| D.阴暗处密封有利于氯水的储存 |