溴化钙(CaBr2·2H2O)是一种白色晶体,易溶于水,有很强的吸湿性,是光敏纸矿泉水和灭火剂的重要成分,在医药上用作治疗神经衰弱等的药物,也用作化学分析。用工业大理石(含有少量Al3+、Fe3+等杂质)制备溴化钙的主要流程如下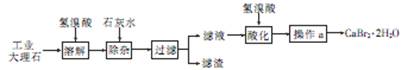
回答下列问题
(1)溶解时发生的主要反应的离子方程式为
(2)除杂步骤控制溶液的pH约为8.0的目的是 ,
(3)滤液用氢溴酸酸化的目的是 ,操作a主要包括 , 和过滤
(4)制得的溴化钙晶体可以通过如下步骤测定其纯度:
①称取5.00g溴化钙晶体样品,②溶解;③滴入足量Naa2CO3溶液,充分反应后过滤,④烘干、冷却;⑤称量。若得到2. 00 g碳酸钙,则样品的纯度为
(5)溴化钙晶体中溴离子和钙离子的检验
①将少量溴化钙晶体溶于水,加入硝酸酸化的AgNO3溶液,实验现象为 ,发生反应的离子方程式为
②将少量溴化钙晶体溶于水,滴加草酸钠溶液,实验现象为 ,发生反应的离子方程式为
元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用。下表列出了①~⑧七种元素在周期表中的位置。
| 族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 2 |
⑤ |
⑥ |
⑧ |
|||||
| 3 |
① |
③ |
④ |
⑦ |
||||
| 4 |
② |
请回答:
(1)画出③的原子结构示意图
(2)在①、②、③三种元素的最高价氧化物对应水化物中,碱性最强的是
(填碱的化学式)。
(3)⑦、⑧两元素对应形成的氢化物中,最稳定的是(填氢化物化学式)。
(4)写出⑤和⑥形成的三原子化合物的化学式
(5)写出①、④元素的最高价氧化物对应水化物之间反应生成的盐的化学式为:。
现有四种有机物:乙烯、乙醇、乙酸、乙酸乙酯。
(1)请分别写出其中含有以下官能团的有机物的名称:
①醇羟基:;②碳碳双键:。
(2)在上述四种有机物中(填写结构简式)
①既能发生加成反应,又能发生聚合反应的是;
②能与NaHCO3溶液反应的是。CH3COOH
“垃圾是放错了位置的资源”,应分类回收利用。生活中废弃的塑料制品、旧轮胎、废纸等属于
| A.单质 | B.有机物 | C.氧化物 | D.无机物 |
早在2004年,国家食品监督局就发出“警惕食品中丙烯酰胺(CH2=CHCONH2)”的公告,丙烯酰胺会在长期炸制食物过程中产生,具有中等毒性,它对人体可造成神经毒性和遗传毒性。已知:有机物H是丙烯酰胺的相邻同系物;A为气态烃,标准状况下密度为2.5g / L,其分子中有2个甲基;F为六元环状化合物。回答下列问题: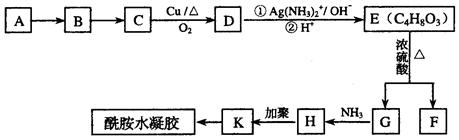
(1)写出G的结构简式__________________ K的结构简式_____________________
(2)指明下列反应类型:A→B:___________________E→G:___________________
(3)写出下列化学方程式:
C→D______________________________________________________________
E→F_______________________________________________________________
(4)下列关于丙烯酰胺的说法,不正确的是________(填选项序号)
①丙烯酰胺所有碳、氮原子不可能在一个平面内 ②人们应改善膳食习惯,少食油炸食品
③丙烯酰胺可发生加成和水解反应 ④酰胺类物质其实就是蛋白质
(5)写出有机物H所有同种类别的同分异构体的结构简式:
__________________________________________________________________________
实验室用乙酸和正丁醇(CH3CH2CH2CH2OH)制备乙酸正丁酯。有关物质的相关数据如下表。
请回答有关问题。
Ⅰ.乙酸正丁酯粗产品的制备(图见右上)
在三孔圆底烧瓶中加入沸石、18.5 mL正丁醇和15.4 mL冰醋酸,再加3~4滴浓硫酸。然后安装分水器
(作用:实验过程中不断分离除去反应生成的水)、温度计及冷凝管(起回流作用),加热使之反应。反应时加热有利于提高酯的产率,但温度过高酯的产率反而降低,其可能的原因是:(答一点即可)
Ⅱ.乙酸正丁酯粗产品的精制
(1)①将圆底烧瓶中的液体转入分液漏斗中,并用饱和Na2CO3溶液洗涤有机层,该步操作的目的是②用分液法可分离上述有机层和水层,取出有机层的操作是
(2)将酯层进行蒸馏。蒸馏收集乙酸正丁酯产品时,应将温度控制在左右
Ⅲ.计算产率
称量制得的乙酸正丁酯的质量为12.76 g,则乙酸正丁酯的产率为