U、V、W、X、Y、Z是原子序数依次增大的六种常见元素。Y的单质在W2中燃烧的产物可使品红溶液褪色。Z和W元素形成的化合物Z3W4具有磁性。U的单质在W2中燃烧可生成UW和UW2两种气体。X的单质是一种金属,该金属在UW2中剧烈燃烧生成黑、白两种固体。
请回答下列问题:
(1)V的单质分子的结构式为 ,XW的电子式为 ;
(2)Z元素在周期表中的位置是 。
(3)元素U、V、W形成的10电子氢化物中,沸点较低的是 (写化学式);结合H+能力较强的是 (写化学式);用一个离子方程式加以说明 。
(4)YW2气体通入BaCl2和HNO3的混合溶液,生成白色沉淀和无色气体VW,有关反应的离子方程式为 ,由此可知VW和YW2还原性较强的是 (写化学式)。
(1)现有以下物质:
aNaCl晶体;b液态SO3;c液态的醋酸;d汞;eBaSO4固体;f纯蔗糖;g酒精;h熔化的KNO3
请回答下列问题(填写相应的字母):
①以上物质中能导电的是________。
②以上物质中属于电解质的是____________。
③以上物质中属于非电解质的是____________。
④以上共价化合物中溶于水后形成的水溶液能导电的是______________。
(2)下列关于氧化物的各项叙述正确的是__________(填写序号)。
①酸性氧化物肯定是非金属氧化物 ②非金属氧化物肯定是酸性氧化物 ③碱性氧化物肯定是金属氧化物 ④金属氧化物都是碱性氧化物 ⑤酸性氧化物均可与水反应生成相应的酸 ⑥与水反应生成酸的氧化物不一定是酸酐,与水反应生成碱的氧化物不一定是碱性氧化物 ⑦不能跟酸反应的氧化物一定能跟碱反应
有机物A(C5H10O)能够发生如图所示的相关反应。已知A分子中含有2个位置不同的甲基,E属于烃类化合物。
(1)A的名称是,Ⅲ的反应类型是。
(2)试剂a最好是。
(3)A的一种同分异构体的核磁共振氢谱中有4个峰,该同分异构体的结构简式为。
(4)与B含有相同官能团的同分异构体有种。
(5)一定条件下,B与C反应生成有香味的有机化合物,写出该反应的化学方程式。
决定物质性质的重要因素是物质的结构。请回答下列问题:
(1)N、O、S三种元素的第一电离能从大到小的顺序为 。
(2)甲醛(H2C=O)分子碳原子的杂化方式为 用价层电子对互斥理论推断甲醛中H—C—H的键角120o(填“>”“<”或“=”)。
(3)科学家通过X射线探明,KCl、MgO、CaO的晶体结构与NaCl的晶体结构相似(图a所示)。KCl、CaO、MgO三种离子晶体熔点从高到低的顺序是。
(4)设MgO晶胞的边长为acm,则MgO的密度是g·cm-3(只要求列算式。阿伏加德罗常数为NA)。
(5)某配合物的分子结构如图b所示,其分子内不含有(填字母)。
| A.离子键 | B.共价键 | C.金属键 | D.配位键 E.氢键 F. 键 键 |

下图是某化学兴趣小组设计的利用电子垃圾(含70%Cu、25%Al、4%Fe及少量Au、Pt)制备硫酸铜和硫酸铝晶体的路线:
已知下列信息:
Cu可与稀硫酸和H2O2的混合液反应生成硫酸铜;铁、铝、铜等离子以氢氧化物形式沉淀时溶液的pH如下表:
| 沉淀物 |
Fe(OH)3 |
Al(OH)3 |
Cu(OH)2 |
| 开始沉淀 |
1.1 |
4.0 |
5.4 |
| 完全沉淀 |
3.2 |
5.2 |
6.7 |
请回答下列问题:
(1)写出Cu与稀硫酸和H2O2的混合液反应的化学方程式:.。
(2)在操作Ⅱ中,x的取值范围是。
(3)在操作Ⅲ中,蒸发浓缩需要的玻璃仪器有。
(4)由滤渣a制取Al2(SO4)3·l8H2O,探究小组设计了三种方案:
综合考虑上述三种方案,最具可行性的是(填序号)。
(5)为测定CuSO4·5H2O晶体的纯度,进行下列实验:取a g试样配成l00 mL溶液,每次取20.00mL,消除干扰离子后,用b mol·L-1EDTA(Na2H2Y)标准溶液滴定其中的Cu2+(离子方程式为Cu2++H2Y2-=CuY2-+2H+),滴定至终点,平均消耗EDTA溶液l2.00 mL。(常温时,5%的Na2H2Y水溶液,其pH为4—6。)
①CuSO4·5H2O晶体的纯度是 。
②下列滴定方式中,最合理的是(夹持部分略去) (填序号)。
氮及其化合物在工农业生产、生活中有着重要作用。
(1)在T℃时,将0.6molH2和0.4molN2置于容积为2 L的密闭容器中(压强为mPa)发生反应:3H2+N2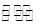 2NH3△H<0。若保持温度不变,某兴趣小组同学测得反应过程中容器内压强随时间变化如图所示:8 min内分钟NH3的平均生成速率为mol·L-1·min-1。
2NH3△H<0。若保持温度不变,某兴趣小组同学测得反应过程中容器内压强随时间变化如图所示:8 min内分钟NH3的平均生成速率为mol·L-1·min-1。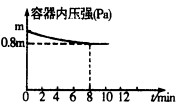
(2)仍在T℃时,将0.6molH2和0.4molN2置于一容积可变的密闭容 器中。
①下列各项能说明该反应已达到平衡状态的是(填序号)。
a.容器内N2、H2、NH3的浓度之比为l:3:2
b.3v正(N2)=v逆(H2)
c.3v正(H2)=2v逆(NH3)
d.混合气体的密度保持不变
e.容器中气体的平均相对分子质量不随时间而变化
②该条件下达到平衡时NH3的体积分数与题(1)条件下NH3的体积分数相比 (填“变大”“变小”或“不变”)。
③达到平衡后,改变某一条件使反应速率发生了如图所示的变化,改 变的条件可能是。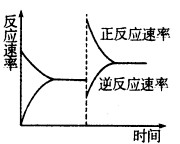
a.升高温度,同时加压
b.降低温度,同时减压
c.保持温度、压强不变,增大反应物浓度
d.保持温度、压强不变,减小生成物浓度
(3)硝酸厂的尾气含有氮氧化物,不经处理直接排放将污染空气。氨气能将氮氧化物还原为氮气和水,其反应机理为:
2NH3(g)+5NO2(g)=7NO(g)+3H2O(g)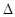 H=-akJ·mol-1
H=-akJ·mol-1
4NH3(g)+6NO(g)=5N2(g)+6H2O(g)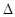 H=-bkJ·mol-1
H=-bkJ·mol-1
则NH3直接将NO2还原为N2的热化学方程式为:。
若标准状况下NO与NO2混合气体40.32L被足量氨水完全吸收,产生标准状况下氮气42.56L。该混合气体中NO与NO2的体积之比为。