铜有两种常见的氧化物:CuO和Cu2O。某学习小组取0.98 g Cu(OH)2 固体加热,有铜的氧化物生成,其质量随温度变化如图1所示;另外,某同学绘制了三条表示金属氧化物与其所含金属元素的质量的关系曲线,如图2所示;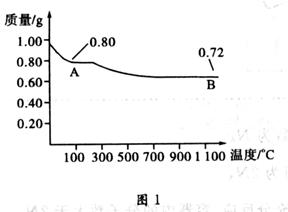

则下列分析正确的是( )
A.图1中产物A、B的化学式分别为Cu2O和CuO
B.图1整个过程中共生成0.26g水
C.图2三条曲线中,表示CuO和其中所含Cu元素质量关系的曲线是C
D.图1中,A到B过程中有0.01 mol电子发生了转移
下列物质与水反应会放出氧气的是
| A.Na2O | B.Na2O2 | C.K | D.NO2 |
下列不是室内污染物的是
| A.CO | B.甲苯 | C.尼古丁 | D.食品袋 |
化石燃料仍是目前能源的主体,但已经面临危机,开发新能源是解决能源问题的关键。下列能量转换过程,不涉及化学变化的是
| A.利用氢氧燃料电池提供电能 |
| B.利用太阳能分解水制备氢气 |
| C.利用水流驱动涡轮机发电 |
| D.利用植物秸秆为原料生产乙醇燃料 |
已知3.01×1023个X气体分子的质量为32g,则X气体的摩尔质量是
| A.16g | B.32g | C.64g /mol | D.32g /mol |
下列过程中,需要加快化学反应速度的是
| A.钢铁腐蚀 | B.食物变质 | C.金属冶炼 | D.塑料老化 |